|
| Безопасность технологии |
 |
| WHO – Всемирная ассоциация здравоохранения |
 |
| UE SCF – Научный комитет по проблемам продовольствия |
 |
| MAFF – Министерство сельского хозяйства, лесных угодий и рыбного промысла Японии |
 |
| EFSA – Европейское агентство по безопасности продуктов питания |
 |
| US FDA – Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США |
|
ГОСТ Р 58162-2018 (ISO/TS 16775:2014)
Группа Р 26
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
УПАКОВКА ДЛЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ, ПОДЛЕЖАЩИХ ФИНИШНОЙ СТЕРИЛИЗАЦИИ
Руководство по применению ИСО 11607-1 и ИСО 11607-2
Packaging for terminally sterilized medical devices. Guidance on the application of ISO 11607-1 and ISO 11607-2 ОКС 11.080 ОКП 94 5120 Дата введения 2019-01-01
Предисловие 1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью "Фармстер" (ООО "Фармстер") на основе официального перевода на русский язык англоязычной версии указанного в пункте 4 документа, который выполнен ФГУП "СТАНДАРТИНФОРМ"
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 383 "Стерилизация медицинской продукции"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 5 июля 2018 г. N 383-ст
4 Настоящий стандарт идентичен международному документу ISO/TS 16775:2014* "Упаковка для медицинских изделий, подлежащих финишной стерилизации. Руководство по применению ИСО 11607-1 и ИСО 11607-2" ("Packaging for terminally sterilized medical devices - Guidance on the application of ISO 11607-1 and ISO 11607-2", IDT)
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение Стерильность содержимого упаковки - барьерная система для стерилизации (до вскрытия ее для применения изделия) требует подтверждения наряду с демонстрацией асептики.
Барьерная система для стерилизации в зависимости от условий обработки, распределения или хранения может обеспечить адекватную защиту для стерильного медицинского изделия. В тех обстоятельствах, когда упакованное и стерилизованное изделие подвергается повторной обработке, может потребоваться, наряду с барьерной системой для стерилизации, дополнительная защитная упаковка, чтобы создать упаковочную систему.
Каждое учреждение должно оценить эффективность каждой барьерной системы для стерилизации или упаковочной системы, прежде чем выбор остановится именно на ней, чтобы обеспечить выполнение условий для стерилизации, хранения и обращения. Каждое учреждение, которое работает со стерильными изделиями, должно иметь документально оформленный план обучения по вопросам хранения, обращения и транспортирования стерильных изделий.
Существуют региональные различия в системах менеджмента качества и другие требования, которые могут включать различные подходы к управлению трудовыми ресурсами. В любом случае процесс основательной подготовки является ключевым элементом, и организация должна обеспечить ознакомление своего персонала с уместностью и важностью их деятельности по упаковыванию и стерилизации в отношении безопасности пациента.
ИСО 11607-1 устанавливает требования к упаковочным материалам, барьерным системам для стерилизации и упаковочным системам, включая аттестацию конструкции упаковочной системы и оценку этой конструкции, ИСО 11607-2 устанавливает требования к валидации процесса упаковывания. Оба этих документа представляют стандарты на обеспечение защиты медицинских изделий, возможности стерилизации, поддержания целостности стерильной упаковки и демонстрации асептики. Область применения каждого из этих стандартов распространяется на учреждения здравоохранения и учреждения, где медицинские изделия упаковывают и стерилизуют. Необходимо признать, что обстоятельства применения этих стандартов будут отличаться, если изделия используются в учреждении здравоохранения, от обстоятельств, если они используются изготовителем медицинских изделий или перерабатывающим предприятием.
Условия использования данного руководства в значительной степени зависит от страны использования. ИСО 11607-1, ИСО 11607-2 и данное руководство дают руководящие указания по их применению, при условии пояснения сопутствующего окружения и регламентных ограничений. В некоторых регионах мира соответствие учреждения здравоохранения стандартам серии ИСО 11607 является требованием регионального или национального регламента, в некоторых регионах серия ИСО 11607 считается руководством для учреждений здравоохранения. Например, признано, что в определенных районах или подпадающих под действие регламента зонах можно продемонстрировать соответствие стандарту ИСО 11607-1 в отличие от соответствия ИСО 11607-2, который требует валидации процесса пользователем. В других регионах, там, где соответствие обоим стандартам - ИСО 11607-1 и ИСО 11607-2 - является требованием национального регламента, данный документ предоставит также руководство по выполнению валидации. Раздел 3 данного документа применим к учреждениям здравоохранения, а раздел 4 применим к промышленности. Дополнительное руководство дается в приложениях А-S, которые можно применить, как указано, к учреждениям здравоохранения и/или промышленности.
В Европе ИСО 11607-1 облегчает изготовителям проведение оценки соответствия и предназначен и используется как инструмент для демонстрации соответствия существенным требованиям директивы по медицинским изделиям. Соответствие стандарту всегда является добровольным.
На момент публикации данного документа на голосование были поставлены изменения к ИСО 11607-1 и ИСО 11607-2. Данное руководство уже учитывает пересмотренные версии, понимая, что нумерация конкретных ссылок может быть изменена. Приложение В ИСО 11607-1 на методы испытаний прошло технический пересмотр и должно учитываться по мере готовности.
1 Область применения Данные технические условия представляют руководство по применению требований стандартов ИСО 11607-1 и ИСО 11607-2. Данный документ не дополняет и не изменяет каким-либо иным образом требования стандартов ИСО 11607-1 и/или ИСО 11607-2. Этот документ является справочным, а не нормативным. Он не включает требования, которые необходимо брать за основу при осуществлении контроля регулирующим органом или при аттестационной оценке.
Это руководство можно использовать для лучшего понимания требований ИСО 11607-1 и/или ИСО 11607-2, оно также иллюстрирует ряд методов и подходов, использующихся для удовлетворения требований этих стандартов. При этом данный документ не требуется использовать для демонстрации соответствия стандартам ИСО 11607-1 и ИСО 11607-2.
Руководящие указания даются для оценивания, выбора и использования упаковочных материалов, предварительно сформированных барьерных систем для стерилизации, барьерных систем для стерилизации и упаковочных систем. Также дается руководство по требованиям валидации процессов формирования, склеивания и сборки.
Настоящие технические условия предоставляют информацию для учреждений здравоохранения (см. раздел 3) и производства медицинских изделий (см. раздел 4).
В документе отсутствуют указания по применению упаковочных материалов и барьерных систем для стерилизации. На применение упаковывания для иных целей, таких как "стерильное поле" или транспортирование загрязненных изделий, разрабатываются другие стандарты.
2 Термины и определения В настоящем стандарте применены термины по ИСО 11607-1 и ИСО 11607-2, а также следующие термины с соответствующими определениями:
2.1 упаковочная система (packaging system): Сочетание барьерных систем для стерилизации (системы защиты стерильности) и защитной упаковки. Примечание - Упаковочная система включает барьерную систему для стерилизации и защитную упаковку. В то же время, если барьерная система для стерилизации защищает медицинское изделие, облегчает асептическое извлечение (содержимого) и достаточно надежна, чтобы не требовать дополнительной защитной упаковки, эта система также выполняет требования упаковочной системы. Защитная упаковка иногда не требуется, в то же время во всех случаях необходимо обеспечить асептический способ вскрытия/извлечения (изделия).
2.2 защитная упаковка (protective packaging): Комбинация материалов, предназначенная для предотвращения повреждения барьерной системы для стерилизации и ее содержимого, в сборе до момента использования. Примечание 1 - Национальные или региональные регламенты могут требовать использования защитной упаковки, чтобы избежать потенциальной контаминации окружающей среды в хирургии. Эти регламенты могут также потребовать удаления защитной упаковки перед вводом барьерной системы для стерилизации в хирургическое поле.
Примечание 2 - Защитная упаковка защищает барьер стерильности и содержимое. Примеры включают пылезащитную оболочку, коробку, лоток для транспортирования.
2.3 барьерная система для стерилизации (СБС) системы защиты стерильности (sterile barrier system SBS): Минимальная упаковка, которая защищает от проникновения микроорганизмов и позволяет извлечь продукт асептическим способом в момент использования. 2.4 предварительно сформированная барьерная система для стерилизации (preformed sterile barrier system): Барьерная система для стерилизации, которая поставляется частично собранной для наполнения и окончательного закрытия или склеивания. Пример - Саше, бумажные пакеты, открытые контейнеры многократного использования. Примечание - Предварительно сформированные барьерные системы для стерилизации существуют в большом разнообразии форм. Примеры, приведенные выше, не претендуют на полноту.
3 Руководство для объектов здравоохранения ВНИМАНИЕ! Изготовитель упаковочного материала и/или медицинского изделия должен представить в письменной форме инструкции по применению с рекомендациями по стерилизации и последующему поддержанию стерильности барьерной системы для стерилизации.
3.1 Методы испытания Руководство по требованиям, предъявляемым к методам испытаний, описанным в ИСО 11607-1 и ИСО 11607-2, представлено в приложениях данного документа.
3.2 Руководство по соответствию требованиям ИСО 11607-1 3.2.1 Общее руководство по материалам, предварительно сформированным в барьерную систему для стерилизации, и барьерным системам для стерилизации
3.2.1.1 Предварительно сформированные барьерные системы для стерилизации, следует оценивать до покупки и использования. Поэтому поставщику следует рассмотреть представление заявления о соответствии применимым разделам ИСО 11607-1 для приобретаемых материалов и/или предварительно сформированных барьерных систем для стерилизации. Прежде чем вводить необходимые компоненты (например, ярлыки, ленты, подложки лотков) в производство пользователям, следует подтвердить, что эти компоненты пригодны для использования в данных конкретных случаях и условиях применения.
3.2.1.2 Основные концепции, применяемые ко всем упаковочным материалам и компонентам, включают следующее:
a) они должны быть изготовлены из известных и прослеживаемых материалов с помощью технологий, соответствующих требованиям ИСО 11607-1 (см. ИСО 11607-1:2006, подпункты 5.1.3-5.1.5);
b) они должны быть нетоксичными, см. подробно приложение А, А.3.3 (ИСО 11607-1:2006, подпункт 5.1.6).
Примечание 1 - Если барьерная система для стерилизации или относящиеся к ней компоненты содержат натуральный латекс, то барьерная система для стерилизации должна снабжаться этикеткой, указывающей на содержание натурального латекса;
c) должно иметься документальное свидетельство, подтверждающее, что они предотвращают проникновение микробов, с демонстрацией в условиях испытания, учитывая процесс стерилизации, обращение, распределение, транспортирование и хранение (см. ИСО 11607-1:2006, подпункт 5.1.6 и пункт 5.2);
d) они должны обладать продемонстрированной способностью соответствовать требующимся физическим свойствам для материалов и закрытий (например, масса и сорт, ширина и прочность клеевого соединения), устойчивостью к разрывам и проколам, обеспечить плавное и равномерное вскрытие или снятие оболочки без отдирания слоев (см. ИСО 11607-1:2006, подпункты 5.1.7 и 5.1.9);
e) они должны быть совместимы с предполагаемым процессом стерилизации и параметрами, обеспечивающими изготовление стерильного медицинского изделия (см. ИСО 11607-1:2006, пункт 5.3);
f) они должны быть совместимы с системой этикетирования, если таковая используется; на этикетке должна использоваться светостойкая прочная типографская краска, которая не разлагается, не обесцвечивается, и текст не теряет четкости после воздействия предполагаемого процесса стерилизации (см. ИСО 11607-1:2006, пункт 5.4);
g) они должны быть защищены от влияния условий окружающей среды (например, относительной влажности, прямого солнечного света или флуоресцентного света, температуры) во время хранения (см. ИСО 11607-1:2006, пункт 5.5 и раздел 7).
Примечание 2 - Предлагаемые условия хранения и срок хранения должны быть указаны изготовителем упаковочного материала или предварительно сформированной барьерной системы для стерилизации. Если предполагаемые или фактические условия хранения не соответствуют предъявляемым требованиям, необходимо проконсультироваться с изготовителем;
h) они должны позволять извлечение содержимого асептическим способом.
Примечание 3 - Инструкции по асептическому извлечению должен предоставить изготовитель медицинского изделия и/или упаковочной системы.
Примечание 4 - Интернет является полезным инструментом для поиска информации по материалам (см. приложение N).
3.2.2 Руководство по разработке и конструкции упаковочных систем (ИСО 11607-1:2006, пункты 6.1 и 6.2)
3.2.2.1 Критерии выбора
Если медицинское учреждение определяет, какую упаковочную систему использовать, то следует рассмотреть руководство по разработке и конструкции упаковочных систем (см. ИСО 11607-1:2006, пункт 6.1 и 6.2). Если медицинское учреждение пользуется по договору услугами изготовителя (поставщика) упаковки или стерилизатора, потребуются дополнительные требования (см. приложение Р).
Выбранные материалы и системы должны:
a) предназначаться для применения в качестве медицинской упаковки, как заявлено изготовителем;
b) поддерживаться технической информацией от изготовителя, подтверждающей соответствие требованиям ИСО 11607-1, касающимся материалов;
c) обеспечивать адекватную защиту для медицинских изделий в течение заданного периода в условиях хранения и транспортирования до места использования;
d) допускать и иметь совместимость с предполагаемым процессом стерилизации, а также способность выдерживать условия выбранного процесса;
Примечание - Не все материалы подходят для процесса стерилизации. Информация о совместимости с данным процессом стерилизации обычно предоставляется изготовителем медицинского изделия и/или упаковочной системы. Дополнительное пояснение относительно выбора обычно используемых процессов стерилизации см. в приложении В.
е) поддерживать целостность барьера стерильности до момента использования;
f) обеспечивать асептический способ вскрытия в момент использования;
g) допускать метод закрытия, который обеспечивает контроль первого вскрытия;
h) давать возможность легкой идентификации содержимого.
Пользователю упаковочных материалов следует обеспечить соответствие упаковочной системы и/или барьерной системы для стерилизации требованиям ИСО 11607-1, чтобы соблюдались требования, касающиеся совместимости продукции и чтобы процессы упаковывания, стерилизации, хранения и распределения проходили валидацию и контроль.
3.2.2.2 Проблемы выбора
Процесс выбора в медицинском учреждении должен включать оценивание способности барьерной системы для стерилизации и защитной упаковки (если требуется), используемой для поддержания целостности барьерной системы для стерилизации до момента использования содержимого, и способности обеспечить асептическое извлечение содержимого в момент использования.
Выбор компонентов упаковки будет зависеть от риска, связанного с медицинским изделием, условий его использования, требований к хранению и транспортированию и медицинских услуг, предоставляемых в рассматриваемом учреждении. Медицинскому учреждению следует проанализировать эти риски и разработать процедуры по их снижению/контролю (см. приложение K).
Чтобы выбрать наиболее подходящий материал для стерильной барьерной системы и/или упаковочной системы, следует учитывать:
a) что продолжительность и условия хранения могут повлиять на тип требующейся барьерной системы для стерилизации. Некоторые изделия можно хранить в течение определенного времени до использования, и может потребоваться более надежная барьерная система для стерилизации и/или добавление защитной упаковки. Чем больше трогают барьерную систему для стерилизации или упаковочную систему, тем больше вероятность появления трещин, деформации крышки, повреждения прокладок, надрывов, дыр или отделения материала;
b) размер, массу и форму стерилизуемого изделия. Некоторые изделия потребуют более прочной или более гибкой барьерной системы для стерилизации, чем другие;
c) при использовании множества типов компонентов важно подтвердить их совместимость друг с другом, а также с содержащимся внутри продуктом и предполагаемым процессом стерилизации;
d) следует учитывать средства и условия транспортирования. Тогда как в ряде случаев маршруты перемещения ограничиваются исключительно помещениями внутри одного здания, в других случаях они могут выходить за рамки одного здания и пролегать между несколькими учреждениями. Воздействие на упаковочные системы неконтролируемых условий окружающей среды увеличивают риски потери целостности упаковки, нарушения асептического вскрытия или контаминации содержимого.
3.2.2.3 Проблемы сборки (формирования)
Следует учесть такие аспекты:
a) медицинские изделия должны быть ориентированы на облегчение асептического извлечения;
b) острые части изделий следует защитить таким образом, чтобы пользователь не поранился и при этом не было причинено повреждений барьерной системе для стерилизации и собственно медицинскому изделию;
c) сопутствующие компоненты можно использовать внутри барьерной системы для стерилизации, чтобы облегчить организацию процесса, сушку или асептическое извлечение (например, внутренняя упаковка, лоток для укладки инструментов, подкладки в лотки или приспособление для вкладывания медицинского изделия);
d) предохранительные устройства или сопутствующие компоненты должны:
1) быть нетоксичными, предназначенными для применения в медицинских упаковках, заявленного изготовителем;
2) обеспечивать защиту медицинского изделия (изделий) во время хранения и транспортирования в место использования;
3) обеспечить совместимость с предполагаемым процессом стерилизации и способность выдерживать условия выбранного процесса;
Примечание 1 - Не все материалы подходят для любого процесса стерилизации. Информацию о совместимости с данным процессом стерилизации обычно предоставляет изготовитель. Дополнительные сведения о вариантах выбора обычных процессов стерилизации см. в приложении В.
4) не подвергаться химическим или физическим изменениям в такой степени, что ухудшатся свойства или безопасность или это негативно отразится на самом медицинском изделии, с которым они соприкасаются;
5) не нарушать асептический способ извлечения;
6) создавать возможность легкой идентификации содержимого;
7) содержаться в контролируемых условиях, чтобы поддерживать чистоту и пригодность к использованию;
e) масса упаковочной системы и ее содержимого не должна выходить за рамки требований национальных регламентов в отношении ручного обслуживания.
Примечание 2 - Действующие национальные регламенты ограничивают массу для ручного обслуживания от 5 до 11,4 кг.
3.2.2.4 Проблемы этикетирования
Часть процесса выбора должна включать вопрос, как производить этикетирование. Процедура этикетирования медицинским учреждением барьерной системы для стерилизации или упаковочной системы должна включать:
a) если идентификацию выполняет само медицинское учреждение:
- для пакетов и рулонов этикетку следует помещать на пленку, если применяется до стерилизации, или на любую сторону, если применяется после стерилизации; этикетка не должна скрывать изделие;
- для пакетов и рулонов печать или надписи следует располагать вне участков, ограниченных наружными размерами клеевых соединений;
- при прикреплении этикеток к наполненным барьерным системам для стерилизации следует соблюдать осторожность, чтобы не повредить упаковочные материалы или содержимое;
b) надписи на упаковочной обертке следует наносить на упаковочную ленту, а не непосредственно на обертку;
c) можно надписать специальные этикетки, предназначенные для конкретных процессов стерилизации. Если используются такие этикетки, они не должны затруднять процесс стерилизации (т.е. не должны блокировать проницаемые участки упаковки);
d) этикетки должны оставаться прикрепленными к барьерной системе для стерилизации в процессе стерилизации и хранения вплоть до момента использования содержимого;
e) этикетки или упаковочные ленты, используемые как этикетки, и системы их приклеивания не должны быть токсичными;
f) следует использовать только нетоксичную типографскую краску, подходящую для использования с выбранным процессом стерилизации;
g) не следует пользоваться шариковыми ручками или любым пишущим устройством, которые могут проткнуть или проколоть барьерную систему для стерилизации.
3.2.2.5 Требования регламентов
Могут применяться конкретные требования национальных или региональных регламентов. Эти требования следует учитывать при выборе барьерной системы для стерилизации и/или упаковочной системы.
3.2.2.6 Традиционный выбор барьерных систем для стерилизации
3.2.2.6.1 Общие положения
Барьерные системы для стерилизации могут производиться с использованием (в основном, но этим не ограничиваясь) следующих концепций:
- склеиваемые пакеты и рулоны; и/или
- стерилизационная обертка; и/или
- контейнер многократного применения (многоразовая упаковка).
При использовании этих систем необходимо рассмотреть следующие аспекты.
3.2.2.6.2 Склеиваемые пакеты и рулоны (предварительно сформированные барьерные системы для стерилизации)
Склеиваемые пакеты и рулоны обычно закупают в двух формах:
- рулон на катушке или бобине представляет собой намотанную двойную ленту, края которой склеены. Рулон разматывают и отрезают кусок нужной длины. Медицинское изделие помещают между двух слоев, а оба конца заклеивают;
- пакет сначала вырезают нужного размера и заклеивают с трех сторон. Медицинское изделие помещают внутрь пакета и заклеивают четвертую сторону.
Необходимо рассмотреть следующие аспекты:
a) размер пакета и прочность упаковочных материалов берут из расчета медицинского изделия, которое требуется упаковать. Изделия слишком крупные для упаковки или с острыми краями будут оказывать дополнительное давление на клеевое соединение и на материалы. Это может привести к разрыву. Для выполнения клеевого соединения должно быть достаточно свободного пространства. Слишком много мелких изделий в одной барьерной системе для стерилизации может привести к перемещениям этих изделий внутри упаковки, разрыву клеевого соединения, перфорации через упаковочные материалы или их истиранию. Тонкие или хрупкие материалы можно повредить при манипуляциях, транспортировании и распределении;
b) если изготовитель не дает иных указаний, предварительно сформированную барьерную систему для стерилизации следует заполнять не более чем на 75% площади внутреннего пространства пористой стороны. Необходимо также следить, чтобы расстояние от клеевых соединений для изделий большей высоты было увеличено;
c) если используются два пакета, внутренний должен двигаться внутри наружного. Это позволяет стерилизующему средству проникать между пакетами, предотвращает слипание пакетов в процессе стерилизации. Следует избегать загибания складок на внутреннем пакете, чтобы он поместился в наружный, или на наружном пакете, чтобы предотвратить создание напряжений или повреждение предварительно сформированной барьерной системы для стерилизации. Для комбинирования двух пакетов, изготовленных из пленки и пористого материала, важно, чтобы пленка стыковалась с пленкой, а пористый материал с пористым материалом для идентификации содержимого и проникновения стерилизующего средства;
d) все клеевые соединения пакета, включая клеевое соединение закрытия, должны быть гладкими, т.е. без складок, пузырьков или морщин;
e) пакеты-самоклейки или с клейкой лентой могут обеспечить меньшую защиту, чем пакеты с запаянными швами. Процедура склеивания диктует, чтобы в местах сложения и закрытия не было перекосов, при этом необходимо следить, чтобы оба угла были хорошо проклеены, чтобы обеспечить полное закрытие по всему краю. Правильное расположение ленты является критическим моментом для обеспечения полного закрытия и, таким образом, целостности барьерной системы для стерилизации. Особое внимание следует уделить надлежащему способу закрытия, чтобы обеспечить целостность упаковки;
f) устройства для склеивания должны контролировать и осуществлять мониторинг критических параметров процесса (например, температуры, давления, выдержки/скорости склеивания) в соответствии с критериями валидации (например, сигнал, система предупреждения или остановка машины в случае отклонения какого-либо критического параметра процесса). Операторам не следует изменять какой-либо из критических параметров процесса, если они не имеют соответствующей подготовки, если изменение полностью не согласуется с соответствующими рабочими процедурами и выходит за рамки процесса валидации. Аппарат для склеивания должен обеспечить соблюдение условий склеивания, предложенных изготовителем барьерной системы для стерилизации. Рекомендуется пользоваться устройствами, специально изготовленными для склеивания предварительно сформированной барьерной системы для стерилизации;
g) вспомогательные приспособления, которые сдавливают упаковку или медицинское изделие при закрытии, применять не допускается (например, веревки, пружины, эластичные полосы, скрепки для бумаги, скрепки для степлера и т.п.);
h) медицинское изделие следует помещать в пакет так, чтобы извлечь его из пакета можно было, не нарушая асептики. Например, рукоятку медицинского изделия следует располагать в направлении открывающегося края. Следует отметить, что клеевые участки после вскрытия считаются нестерильными [108];
i) пакет следует открывать по инструкциям изготовителя: если существует определенная ориентация, чтобы предотвратить расслоение волокон при вскрытии, необходимо соблюдать эту ориентацию. Сформированная упаковка должна по своей конструкции показывать, в каком направлении должна открываться упаковка (например, знак стрелки, форма клеевого соединения);
j) рулоны (катушки) используют для упаковывания медицинских изделий различных размеров, которые плохо подходят к размерам пакетов в стандартном исполнении. Ввиду того, что упаковка склеивается с двух сторон, угол склеивания (шеврон) отсутствует. В отсутствие шеврона направление отслаивания для рулонов должно быть указано изготовителем. Кроме того, рекомендуется иметь больше пространства над клеевым соединением, которое предназначается для вскрытия в соответствии с указанием изготовителя.
Примечание - В большинстве стран мира определенные барьерные системы для стерилизации, которые невозможно просто открыть, а требуется разрезать для получения доступа к помещенному внутри изделию, используются вместо легко открывающихся предварительно сформированных барьерных систем для стерилизации: например, некоторые барьерные системы для стерилизации, сформированные с помощью пакетов для стерилизации, пакетов, запечатанных с помощью этикетки, загибающейся пополам, или пакетов, полученных из рулонного материала, сконструированного из одного пористого слоя и одного слоя пластиковой пленки, склеенных вместе по параллельным сторонам. В таких вариантах велик риск контакта изделия с нестерильной наружной поверхностью барьерной системы для стерилизации и необходимо уделять дополнительное внимание асептическому способу извлечения. Это достигается срезанием верхней части упаковки, переворачиванием ее вниз разрезом, чтобы дать изделию выпасть на подходящую поверхность, не касаясь наружных сторон.
3.2.2.6.3 Обертка для стерилизации
Обертка для стерилизации поступает в продажу в множестве размеров и сортов для широкого диапазона применений. Она также выпускается в форме однократного или многократного применения. Особое внимание следует уделять заворачиваемому изделию и используемой технике обертывания. Обертку для стерилизации можно использовать для обертывания индивидуальных медицинских изделий или медицинских изделий в коробках для инструментов, кассетах или органайзерах.
Следует учесть следующие аспекты:
a) сорт обертки для стерилизации следует выбрать в соответствии с размером, формой и массой заворачиваемых медицинских изделий или исходя из руководящих указаний объекта здравоохранения и рекомендаций изготовителя обертки по применению;
b) размер обертки следует выбирать для надлежащего укрытия упаковываемого изделия. Важно, чтобы изделие было завернуто без образования зазоров, волн и воздушных карманов. Изделие не следует завертывать слишком плотно, поскольку это может привести к образованию отверстий и разрывов на обертке. Также необходимо, чтобы обертка была достаточно большой, чтобы обеспечить ее перемещение во время цикла стерилизации без разрывов и отрывов. При выборе листов обертки для стерилизации необходимо учитывать, что размер обертки должен быть достаточным, чтобы укрыть медицинское изделие, но не настолько большим, чтобы обернуть ее несколько раз вокруг медицинского изделия, ухудшая проникание стерилизующего средства;
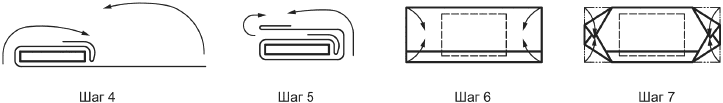
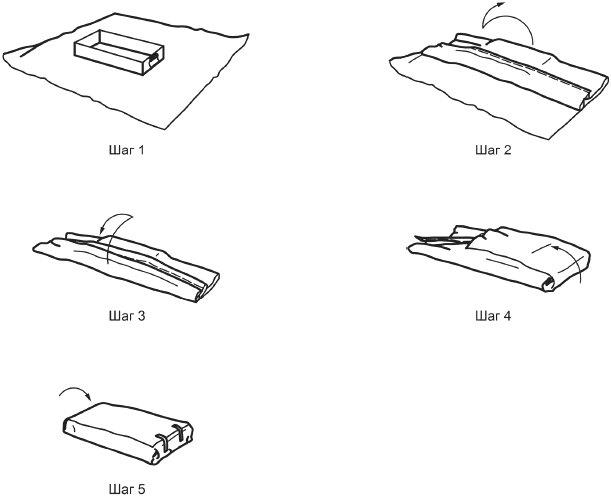
c) большое значение имеет надлежащая техника обертывания, чтобы обеспечить извилистый путь, препятствующий миграции микробов в барьерную систему для стерилизации. Технику обертывания можно использовать, если изготовитель продемонстрировал эффективность этой техники и рекомендует ее для применения (см. 3.2.2.1). Выбранный метод обертывания должен предусматривать асептическое извлечение стерильного медицинского изделия. Медицинское учреждение должно провести верификацию и валидацию этой техники своими средствами на соответствие национальным или региональным регламентам. Могут существовать национальные стандарты или профессиональные руководства по способам обертывания. Примеры приведены в приложении С;
d) техника обертывания для стерилизации должна предусматривать возможность сбрасывания открытой обертки со стерильного поля;
e) площадь поверхности сборки для обертывания должна быть плоской, гладкой, адекватного размера, хорошо освещенной и чистой;
f) обернутая упаковка должна быть сформирована таким образом, чтобы все кромки были защищены и не попали в стерильное поле во время асептического извлечения медицинского изделия;
g) системы закрытия должны обеспечить очевидность повреждения, порчи, вскрытия;
h) для закрытия обернутых упаковок наиболее широко используется индикаторная лента, которой существует множество в зависимости от метода стерилизации. Существует множество лент, которые используются для тканых и нетканых оберток. Вспомогательные приспособления, которые сдавливают упаковку или медицинское изделие при закрытии, применять не допускается (например, веревки, пружины, эластичные полосы, скрепки для бумаги, скрепки для степлера и т.п.);
i) в случае использования в качестве обертки для стерилизации ткани многократного применения существуют дополнительные требования, чтобы обеспечить пригодность обертки перед каждым использованием (см. ИСО 11607-1:2006, подпункты 5.1.11 и 5.1.12).
3.2.2.6.4 Контейнеры многократного использования
Жесткий контейнер многократного использования сконструирован для помещения медицинских изделий и принадлежностей и стерилизуется без обертывания снаружи. Такой контейнер обычно включает дно или основание с ручками для переноски и крышку, которая крепится к основанию с помощью фиксирующего устройства. В контейнере может находиться корзинка или лоток для помещения медицинских изделий. В контейнере имеются средства для откачки воздуха и подачи стерилизующего средства. В региональных или других стандартах эти контейнеры могут называться "жесткий контейнер" или "контейнер многократного использования".
Футляры для набора инструментов, кассеты или органайзеры являются средствами для вмещения, но не барьерными системами для стерилизации. Они должны сами помещаться в барьерные системы для стерилизации.
При использовании жестких контейнеров необходимо учесть следующее (см. ИСО 11607-1:2006, подпункт 5.1.10):
a) следует использовать только те фильтры, которые совместимы с конкретным контейнером, конкретным процессом стерилизации и поддерживают стерильность. Изготовитель фильтров должен представить документированное свидетельство, демонстрирующее возможности фильтров;
b) контейнеры следует проверять и готовить в соответствии с инструкциями изготовителя;
c) индикаторы повреждения, несанкционированного вскрытия (возможного нарушения стерильности), совместимые с процессом стерилизации, должны прикрепляться в соответствии с инструкциями изготовителя контейнера и показывать, что барьерная система для стерилизации не была намеренно или случайно вскрыта и поэтому содержимое не подверглось потенциальной контаминации перед предполагаемым использованием;
d) на каждом контейнере в зоне видимости должна находиться этикетка и/или информационная табличка, если только контейнер не предназначен для стерилизации в чрезвычайных ситуациях и используется для этой цели. Этикетка или табличка ID должна быть совместима с процессом стерилизации;
e) поверхности склеивания основания и крышку следует проверять на повреждение каждый раз перед использованием, чтобы обеспечить плотное закупоривание;
f) размеры органайзера для медицинских изделий должны подходить для конкретного контейнера и метода стерилизации;
g) должны иметься инструкции по технологии очистки, дезинфекции и техническому обслуживанию контейнеров после каждого применения. Эти технологии должны пройти валидацию. Контейнеры не допускается использовать после указанной изготовителем даты окончания срока годности (см. ИСО 11607-1:2006, подпункт 5.1.12). Должны действовать процедуры, обеспечивающие прекращение использования контейнеров по истечении срока их годности, указанного изготовителем (см. ИСО 11607-1:2006, подпункт 5.1.12);
h) в любой барьерной системе для стерилизации, чтобы обеспечить асептическое извлечение содержимого, наружная сторона контейнера и соединение между верхней и нижней сторонами не должны соприкасаться со стерильным содержимым.
3.2.2.7 Защитная упаковка
Для защиты или продления срока хранения надлежащим образом упакованных и стерилизованных медицинских изделий, которые могут подвергаться воздействию окружающей среды или многократным манипуляциям, можно использовать защитную упаковку. Транспортирование или перемещение барьерной системы для стерилизации, в частности, может потребовать применения защитной упаковки, чтобы перевозка и манипуляции не повлияли на барьерную систему для стерилизации. Стерилизованные упаковки следует как можно меньше трогать. Нарушение целостности барьерной системы для стерилизации считается связанным с событием, а не со временем, поэтому так важно защитить стерильную барьерную систему от повреждения.
При использовании защитной упаковки барьерная система для стерилизации должна быть четко идентифицируема. Защитная упаковка конструируется для дополнительной защиты от повреждений и внешних элементов. Если после стерилизации паром необходимо использовать защитную упаковку, ее применяют после тщательной сушки и охлаждения изделий.
Национальные или региональные регламенты могут потребовать применения защитной упаковки с целью избежать потенциальной контаминации окружающей среды в хирургии. Эти же регламенты могут потребовать удаления защитной упаковки перед введением барьерной системы для стерилизации в хирургическое поле.
3.2.3 Эксплуатационные испытания упаковочной системы (ИСО 11607-1:2006, пункты 5.3-5.5, 6.3) Прежде чем использовать упаковочную систему в учреждении в первый раз, следует испытать ее характеристики. Эксплуатационные испытания должны предусматривать верификацию, насколько хорошо барьерная система для стерилизации или упаковочная система выдерживает предполагаемые условия обращения, распределения и транспортирования до и после стерилизации. Барьерная система для стерилизации должна поддерживаться в целостности, без отверстий, надрывов или разрывов клеевого слоя/закрытия, причиной которых могут стать остаточные напряжения.
Эксплуатационные испытания предполагают:
a) оценку в ходе предполагаемых процессов стерилизации, обращения, распределения и хранения вплоть до места использования;
b) оценку для ожидаемых наиболее неблагоприятных сценариев. Для этого необходимо рассмотреть ряд факторов. Сюда входит (но этим не ограничивается):
1) сборка барьерных систем для стерилизации, содержащих медицинское изделие такой конфигурации, которая представляет максимальные проблемы для барьерной системы (например, наиболее крупные, тяжелые, плотные изделия с острыми краями, см. ИСО 11607-1:2006, пункт 6.3.4);
2) пробы для верификации следует готовить так, чтобы дать возможность мониторинга эффективности процесса стерилизации в зависимости от национальных и региональных требований к мониторингу эффективности стерилизации. Примеры включают (но этим не ограничиваются) биологические, химические индикаторы или устройства контроля процесса (PCD=УКП) посредством измерения и записи физических параметров, используя термопары или устройства регистрации данных. Определение пригодности можно осуществить параллельно с валидацией процесса (процессов) стерилизации, который предполагается использовать. Медицинские изделия следует упаковывать и стерилизовать согласно инструкциям изготовителя медицинского изделия и предварительно сформированной барьерной системы для стерилизации;
3) стерилизация барьерной системы с помощью предполагаемого процесса стерилизации с учетом смешанных нагрузок или в полностью загруженных стерилизационных камерах;
4) распределение/обращение/хранение/вскрытие барьерной системы для стерилизации.
Следует рассмотреть окружающую среду и другие условия, в которых будет храниться барьерная система для стерилизации или упаковочная система. Изделие, плотно зажатое в емкостях и местах хранения, имеет больший шанс прорыва упаковки при движении друг относительно друга двух комплектов упакованных медицинских изделий и может оказаться поврежденным через проколы и разрывы.
Особенно важно учесть все условия хранения и распределения, поскольку большинство мест стерилизации расположено вдали от места использования.
После эксплуатационных испытаний медицинские учреждения должны визуально проверить образцы барьерных систем для стерилизации на целостность упаковки (отсутствие дыр и разрывов) и целостность клеевых соединений, а также подтвердить проведение стерилизации при заданных параметрах.
Если желательно провести более тщательные испытания, можно найти альтернативные методы в ИСО 11607-1:2006, приложение В.
Если барьерная система для стерилизации предусматривает многократное использование и ухудшение эксплуатационных характеристик спрогнозировано изготовителем (см. ИСО 11607-1:2006, подпункты 5.1.11 и 5.1.12), используемая система мониторинга или контроля должна четко идентифицировать достижение окончания срока годности, определенного изготовителем.
3.2.4 Оценка стабильности барьерной системы для стерилизации (срок хранения) (ИСО 11607-1:2006, пункт 6.4) Оценку способности материалов барьерной системы для стерилизации или предварительно сформированной барьерной системы для стерилизации поддерживать свои эксплуатационные характеристики и целостность клеевого соединения с течением времени обычно выполняет изготовитель предварительно сформированной барьерной системы для стерилизации (см. также ИСО 11607-1:2006, подпункт 6.4.7).
В то же время даже в случае, когда материалы сохраняют свойства приемлемого микробного барьера, медицинское учреждение должно продемонстрировать, что барьерная система для стерилизации или упаковочная система в сборе может поддерживать целостность в предполагаемых условиях окружающей среды до момента использования.
Считается, что потеря целостности барьерной системой для стерилизации связана с событием, а не со временем, и зависит от исполнения барьерной системы для стерилизации или упаковочной системы, а также от возможного взаимодействия между медицинским изделием и выбранной барьерной системой для стерилизации, условий хранения, условий при перевозке и количества манипуляций. Подходящая среда для хранения включает широкий спектр проблем, т.е. предотвращение повреждений, поддержание определенной температуры и стабильной влажности, ограничение воздействия пыли и прямого солнечного света, удерживание защитной упаковки на одном месте, сводя к минимуму перемещения, физическое разделение чистых и загрязненных изделий и т.д.
На максимальные усилия по поддержанию целостности упаковки путем ограничения риска повреждения барьерной системы для стерилизации значительное влияние могут оказать адекватное управление складским хозяйством и система менеджмента.
Примечание - Национальное или региональное руководство может дать дополнительную информацию о требованиях к хранению, например расстояние до пола и до потолка, обновление запасов, уборка складских помещений, более конкретные ограничения для температуры и влажности, тип расстановки в специальном газонепроницаемом закрытом помещении, воздухообмене в вентиляции и качестве воздуха, частицах в воздухе.
3.2.5 Документация
Медицинское учреждение должно следовать планам или критериям оценки выбора барьерных систем для стерилизации. Результаты испытаний следует сравнить с критериями приемлемости. Результаты оценки следует задокументировать.
Документы о валидации и собранные данные необходимо вести в соответствии с политикой медицинского учреждения. ИСО 11607-1:2006, пункт 7.1, требует, чтобы документированная информация включала идентификацию типа, размера или сорта и номера партии испытанных материалов, процессов стерилизации, все известные даты истечения срока годности или предлагаемые условия хранения, все известные ограничения на обращение или использование, сведения, касающиеся материалов повторного использования, допустимую частоту и характер технического обслуживания.
3.3 Руководство по соответствию ИСО 11607-2. Требования валидации процессов формирования, склеивания и сборки*
3.3.1 Общие положения ИСО 11607-2 описывает требования к валидации всех процессов упаковывания. Сюда включены сборка или наполнение и следующие процессы:
- процесс склеивания: формирование и склеивание рулона или пакета;
- процесс обертывания: складывание и закрытие стерилизационной обертки;
- процесс с контейнерами: закрытие многократно используемого контейнера.
Валидация процессов может соотноситься с датой предыдущей аттестации монтажа (IQ) и аттестацией эксплуатации (OQ). Эти данные можно использовать для определения допусков для критических параметров.
Деятельность в рамках процесса упаковывания должна осуществляться в рамках официальной системы менеджмента качества. Поскольку имеются региональные различия в системах качества здравоохранения, основные элементы включают (но этим не ограничиваются) эффективную систему контроля документации, процесс получения образования в учебном заведении, контроль/мониторинг процессов и систему корректирующих действий и профилактики для поддержания (и постоянного улучшения) результативности процессов упаковывания.
Все определения IQ, OQ и аттестации эксплуатируемого оборудования (PQ) в ИСО 11607-2 относятся к оборудованию, используемому для процессов склеивания или закрытия. В то же время все процессы формирования, склеивания и сборки требуют ручных операций. Следовательно, все функции, выполняемые работниками, следует включить как часть валидации.
Обычно при установке оборудования выполняют только IQ. Альтернативно для процесса, который включает только людей и исполнение ими задач, разработка типовых рабочих инструкций (SOP) и обучение по ним может рассматриваться некоторыми учреждениями как IQ. Обучение конкретных операторов, нанятых для проведения аттестаций OQ и PQ, следует документировать в отчетах.
3.3.2 Метод валидации
3.3.2.1 Общие положения
По сути, должен существовать документированный метод валидации или стандартный метод валидации.
Данный документированный метод состоит в следующем:
a) разработка плана валидации (см. 3.3.2.2);
b) выполнение валидации (см. 3.3.2.3):
1) IQ (см. ИСО 11607-2:2006, пункт 5.2);
2) OQ (см. ИСО 11607-2:2006, пункт 5.3);
3) PQ (см. ИСО 11607-2:2006, пункт 5.4);
c) необходимая процедура обработки отказа и корректирующее действие;
d) утверждение валидации (см. 3.3.2.4);
e) контроль процесса и текущий мониторинг (см. 3.3.2.5);
f) изменения процесса/упаковывания и повторная валидация (ревалидация) (см. 3.3.2.6).
3.3.2.2 Разработка плана валидации
Как минимум план валидации должен включать следующую информацию:
a) ответственность (т.е. учреждение, местоположение, Ф.И.О. ответственного за валидацию и исполнителя);
b) описание процедур склеивания и закрытия/SOP (например, термосклеивание пакетов, обертывание и закрытие барьерной системы для стерилизации, загрузка и закрытие контейнера);
c) описание барьерных систем для стерилизации и, если требуется, необязательной защитной упаковки (например, описание изготовителя);
d) описание содержимого используемых барьерных систем для стерилизации. Барьерные системы для стерилизации собирают, как для обычного использования, см. 3.2.2.3, 3.2.2.4, 3.2.2.6 и 3.2.2.7;
е) описание процесса стерилизации [например, стерилизация влажным паром при температуре 134 и 121°С, этиленоксидом (ЕО), газовой плазмой, низкотемпературная пароформальдегидная (LTSF)], включая параметры процесса и используемую конфигурацию нагрузки;
f) описание транспортирования, распределения и хранения соответствующих барьерных систем для стерилизации;
g) этапы аттестации (IQ, OQ и PQ) (см. ИСО 11607-2:2006, пункты 5.2-5.4) для дополнительных пояснений по каждому процессу см. 3.3.2.7-3.3.2.9;
h) объем выборки с учетом того, что число испытуемых единиц берется на основе статистически достоверного обоснования (см. приложение L).
Примечание - Размер выборки заметно влияет на доверительный уровень и надежность. Инструменты для определения размера выборки можно легко подобрать поиском в Интернете, используя ключевые слова "выборка", "размер", "калькулятор";
i) критерии приемки с учетом того, что пользователю следует определить, какие атрибуты предполагается оценивать, метод оценки и результаты, которые будут считаться приемлемыми;
j) утверждение валидации.
Можно пользоваться бланком плана валидации, представленным в приложении D, D.2-D.4. Для различных комбинаций процесс стерилизации/барьерная система для стерилизации и/или упаковочная система (изготовитель, тип и т.д.) следует использовать отдельный план валидации. Таблицу D.1, представленную в приложении D, можно использовать для организационных целей.
3.3.2.3 Выполнение валидации
После разработки плана валидации приступают к собственно валидации по этому плану. Для руководства конкретно по каждому из трех процессов, описанных в 3.3.1, см. следующие подразделы: процесс склеивания (3.3.2.7), процесс обертывания (3.3.2.8) и процесс помещения в контейнер (3.3.2.9).
3.3.2.4 Утверждение валидации
Документированный и оцененный отчет о валидации должен обеспечить прослеживаемость и утверждаться ответственным лицом в соответствии с утвержденным планом валидации (см. приложение D, D.2-D.4).
Отклонения следует обсудить и утвердить до утверждения отчета о валидации. Следует оценить влияние отклонения на валидационное исследование, чтобы понять, требуется ли повторить исследование.
Отчет по аттестации IQ следует утвердить до начала аттестации OQ. Аналогично отчет по аттестации OQ следует утвердить до начала аттестации PQ.
После каждого этапа необходимо изучить отклонения или отказы, чтобы определить основную причину и выполнить корректирующее действие до начала следующего этапа валидации. Следует оценить необходимость полного или частичного повторения предыдущего этапа валидации. Корректирующими и превентивными действиями управляют с помощью установленной системы менеджмента, а результативность этих действий оценивают и документируют.
3.3.2.5 Контроль процесса и текущий мониторинг
Необходимо разработать процедуры, обеспечивающие контроль процесса упаковывания и установленных параметров процесса во время нормальной работы.
Критические параметры процесса подлежат текущему контролю и документированию.
3.3.2.6 Изменения процесса/упаковки и повторная валидация
3.3.2.6.1 Процессы подлежат повторной валидации, если произошли изменения в оборудовании, продукции, упаковочных материалах или процессе упаковывания, которые могут свести на нет первоначальную валидацию и повлиять на стерильность, безопасность или адекватность стерильных медицинских изделий. Для подтверждения такого заключения требуется документированное обоснование.
Примечание - Ниже следует перечень изменений, которые могут повлиять на статус процесса валидации и требуют повторной валидации:
- изменения материалов барьерной системы для стерилизации;
- новое оборудование;
- перенос процессов и/или оборудования из одного учреждения или места в другое;
- изменения процесса стерилизации;
- анализ жалоб конечного пользователя или несоответствующая требованиям продукция, отрицательная динамика индикаторов контроля качества и процесса;
- изменение содержимого барьерной системы для стерилизации, выходящее за рамки ранее оцененных параметров наихудшего случая;
- изменение средств транспортирования или маршрута (например, от перемещений только внутри здания к перемещению между зданиями, что может привести к значительному изменению выбираемой упаковки).
3.3.2.6.2 Потребность в повторной валидации следует оценить и задокументировать. Если изменение не требует повторения всех аспектов первоначальной валидации, то повторная валидация не должна быть такой развернутой, как первоначальная, причем для повторной валидации требуется документированное обоснование.
3.3.2.6.3 Документированное обоснование пишут для приемки изменений, которые не требуют повторной валидации (например, изменение материала или смена поставщика материала, если поставщик представит свидетельство о том, что материалы практически эквивалентны).
3.3.2.6.4 Рекомендуется рассмотреть возможность периодически повторяемой валидации, верификации или анализа, поскольку накапливание множества мелких изменений в сумме может повлиять на статус валидации процесса.
Повторные валидации можно также использовать для демонстрации требующихся знаний и умений работников для эффективного осуществления процессов, а также для переквалификации персонала и усовершенствования практики.
3.3.2.7 Валидация процесса склеивания (термосклеивания, термосварки) (формирование и склеивание рулона или пакета) предварительно сформированных барьерных систем для стерилизации.
Примечание - Изготовитель предварительно сформированной барьерной системы для стерилизации предоставляет информацию о валидации процесса склеивания на выполненных клеевых соединениях; такая валидация касается клеевого соединения закрытия, выполняемого на месте, в медицинском учреждении.
3.3.2.7.1 Аттестация монтажа (установочная квалификация IQ)
Это означает, что устройство (аппарат) для термосклеивания (термосварки) должно быть совместимым и правильно установленным. Оборудование для термосклеивания должно поставляться с завода с предварительной калибровкой и сертификатом, а медицинское учреждение должно иметь программу текущих проверок, чтобы обеспечить надлежащие параметры термосклеивания для соединяемых поверхностей. Кроме того, пользователь должен пройти подготовку, как правильно работать с устройством для сваривания.
Следующие аспекты аттестации IQ учитывают условия окружающей среды, такие как чистота помещения, температура, влажность; документированные/действующие методики обучения; справочники и инструкции по эксплуатации.
Необходимо рассмотреть следующие вопросы:
a) Определены ли критические параметры процесса (например, такие как температура, контактное давление и время термосклеивания/паузы)?
Примечание 1 - При использовании ротационного термосварочного оборудования время паузы обычно выражается через скорость сваривания (т.е. метров в минуту). Если используется термосварочное оборудование челюстного типа, то время паузы - это время, в течение которого нагретые элементы (челюсти) находятся в сомкнутом состоянии в контакте со свариваемым материалом.
b) Основана ли температура сваривания на рекомендациях изготовителя предварительно сформированной барьерной системы для стерилизации?
c) Оснащен ли сварочный аппарат системами контроля и мониторинга критических параметров процесса?
d) Оснащен ли сварочный аппарат системами сигнализации, предупреждения или выключателем аппарата на случай превышения пределов критическими параметрами?
e) Известны ли и понятны ли технические требования к создаваемым соединениям (т.е. ширина конкретного сварочного шва, если этот параметр регулируется национальными стандартами)?
f) Доступны ли для пользователей документированные планы по профилактическому обслуживанию и очистке?
g) Все ли пользователи проходят подготовку по эксплуатации сварочного оборудования и оформляется ли это документально?
Для выполнения аттестации IQ рекомендуется использовать контрольные листы.
Примечание 2 - Контрольные листы аттестации IQ в приложении Е, Е.1, можно использовать для документации.
3.3.2.7.2 Аттестация эксплуатации (операционная квалификация OQ)
Диапазон температур сварки, которые предполагает использовать медицинское учреждение, определяет само учреждение, пользуясь информацией, предоставленной изготовителем барьерной системы для стерилизации и изготовителем оборудования для термосварки.
Изготовитель предварительно сформированной барьерной системы для стерилизации обычно дает верхнюю и нижнюю границу диапазона, при определенном давлении и времени паузы.
Изготовитель сварочного оборудования обычно предоставляет информацию о мониторинге критических параметров.
Контактное давление и время сварки/паузы обычно представлены в определенном диапазоне изготовителем оборудования для термосварки, и важно обеспечить возможность достижения аппаратом пределов, рекомендованных изготовителем предварительно сформированной барьерной системы для стерилизации. В условиях эксплуатации различные барьерные системы могут потребовать различных температур сваривания.
С помощью предоставленной информации пользователь сваривает барьерные системы для стерилизации при верхнем и нижнем предельных значениях диапазона и оценивает качество полученных соединений. Перед применением следует проверить наличие калибровки сварочного оборудования.
Операторы должны пройти подготовку и проверку знания процесса термосварки.
Упаковку следует собирать в соответствии с документированными инструкциями. При сборке упаковки следует учитывать случай наихудшей конфигурации (см. приложение Н).
Необходимо склеить образцы при каждом верхнем и нижнем предельном значении диапазона критического параметра и оценить результат. Для того чтобы утвердить для рассматриваемого параметра предельное значение, необходимо, чтобы все образцы, склеенные при этом значении, прошли критерии приемки. Критерии приемки для склеенных барьерных систем для стерилизации включают:
a) цельное клеевое соединение установленной ширины;
b) отсутствие каналов или открытых швов;
c) отсутствие проколов и надрывов;
d) отсутствие морщин и складок поперек шва;
e) после предусмотренного процесса стерилизации отсутствие расслоения материала или разрыва волокон при вскрытии упаковки с отслаиваемой поверхностью может помешать асептическому извлечению.
Если для оценивания клеевых соединений используются разрушающие испытания, то необходимо подготовить несколько серий упакованных изделий на параметр склеивания.
Чтобы выполнить приведенные выше критерии после стерилизации, может потребоваться минимальная прочность клеевого соединения (например, ЕН 868-5 указывает минимальное опорное значение 1,5 Н на 15 мм для процессов паровой стерилизации и 1,2 Н на 15 мм для других процессов стерилизации). Если измерение прочности клеевого соединения не проводится в ходе OQ, существует повышенный риск несоответствия приемочным критериям в ходе PQ, что потребует заново выполнить аттестацию OQ.
Качественные свойства проверяют на соответствующей системе (например, в продаже имеются наборы для испытания на проникновение красителя или другого индикатора целостности клеевого соединения; см. приложение А, А.7.3). Результаты документируют.
Примечание 1 - Индикатор целостности клеевого соединения должен состоять из такого же материала, что и пористый материал в пакете или рулоне (например, ЕН 868-3). Если параметры качества достигаются при верхнем и нижем предельных значениях диапазона, то установочное значение обычно лежит посередине между двумя этими значениями (например, если нижнее предельное значение = 170°С, а верхнее = 190°С, то температура термосклеивания составит 180°С).
Примечание 2 - Контрольный лист OQ в приложении Е, Е.1, можно использовать для определения температуры термосклеивания.
3.3.2.7.3 Аттестация эксплуатируемого оборудования (эксплуатационная квалификация PQ)
Аттестация PQ показывает, что процесс, включая и оборудование, и оператора, последовательно производит приемлемые барьерные системы для стерилизации в заданных рабочих условиях.
Необходимо учесть следующее:
а) оценивание барьерной системы для стерилизации проводят после ее склеивания и стерилизации;
b) документация на партии, использованные в ходе валидационных исследований, образует часть записей о валидации. Идентификация партии должна включать (но этим не ограничиваться) следующее:
1) оператора;
2) время и дату;
3) процесс стерилизации, параметры и число циклов;
4) использованные материалы барьерной системы для стерилизации;
5) содержимое барьерной системы для стерилизации;
6) использованное оборудование для термосклеивания;
c) калибровку испытательного оборудования и аппаратов для термосклеивания проверяют с помощью метода, рекомендованного изготовителем. Проверку осуществляют до начала склеивания;
d) склеивают и оценивают образцы. Все образцы должны соответствовать приемочным критериям. Информацию по объему выборки см. в 3.3.2.2, перечисление h).
Чтобы выполнить приемочные критерии после стерилизации, может потребоваться минимальная прочность клеевого соединения (например, ЕН 868-5 указывает минимальное опорное значение 1,5 Н на 15 мм для процессов паровой стерилизации и 1,2 Н на 15 мм для других процессов стерилизации).
Если для оценивания клеевых соединений используются разрушающие испытания, то необходимо подготовить несколько серий упакованных изделий на параметр склеивания;
e) следует подготовить три партии или серии склеенных барьерных систем для стерилизации; эти партии включают потенциально значимые источники изменчивости, такие как оператор, время суток, материал (размер, источник, контролируемая партия), содержимое барьерных систем для стерилизации. Следует также включить содержимое упаковки, которое представляет наибольшую проблему (наихудший случай);
f) образцы барьерной системы для стерилизации стерилизуют, используя процесс стерилизации, заранее определенный как подходящий для демонстрации пригодности барьерной системы для стерилизации. Три партии образцов подвергают одному и тому же процессу стерилизации тремя отдельными циклами, чтобы продемонстрировать воспроизводимость;
g) барьерные системы для стерилизации оценивают после стерилизации и после наиболее неблагоприятного варианта условий обращения, распределения и хранения, используя критерий приемки из аттестации OQ. Результаты документируют. См. также 3.2.3 и ИСО 11607-1:2006, пункт 6.3.
Примечание - Для документации можно использовать контрольный лист для PQ из приложения G, G.1.
3.3.2.7.4 Самозаклеивающиеся пакеты или заклеивающиеся с помощью ленты
Притом что не рекомендуется использовать самозаклеивающиеся или заклеивающиеся с помощью ленты пакеты, если имеется оборудование для термозаклеивания пакетов, сборка и закрытие пакетов подлежат валидации, если эти процессы происходят (см. ИСО 11607-2:2006, подпункт 5.1.1). Рассматривают все соответствующие элементы и этапы валидации, подробно описанные в ИСО 11607-2:2006, раздел 5.
3.3.2.8 Валидация процесса обертывания (складывание и закрытие обертки для стерилизации)
3.3.2.8.1 Аттестация монтажа (установочная квалификация IQ)
Хотя процесс обертывания - это в основном ручная работа, рассматривают следующие аспекты IQ: условия окружающей среды, например чистоту помещения, температуру, влажность; документированное/проведенное обучение; инструкции или справочник по эксплуатации.
3.3.2.8.2 Аттестация эксплуатации (операционная квалификация OQ)
Должен иметься документированный способ сборки упаковок. Этот метод должен учитывать 3.2.2.3 и 3.2.2.6.3. Руководство по сборке и закрытию оберточных упаковок можно получить у изготовителя обертки.
Операторы проходят обучение и испытания на компетенцию.
Способы складывания включают в себя получение извилистого пути для препятствия прохождения микроорганизмов (см. приложение С).
Упаковки собирают в соответствии с документированной процедурой. Необходимо включить наиболее неблагоприятный случай конфигурации изделия (см. приложение Н). Образцы закрывают/заклеивают и оценивают. Все образцы должны пройти критерии приемки. Руководство по объему выборки см. в 3.3.2.2, перечисление h), и приложении L.
В зависимости от методов, используемых для оценки закрытия, готовят несколько наборов на партию.
Барьерные системы для стерилизации оценивают на целостность и надлежащее закрытие. Критерии приемки включают (но этим не ограничиваются) следующее:
a) непрерывность и целостность клеевого соединения;
b) отсутствие каналов или открытых швов и зазоров;
c) отсутствие проколов и надрывов;
d) отсутствие расслоения материала или разделения при вскрытии;
e) развертывание или вскрытие должно продемонстрировать, что барьерная система для стерилизации способна обеспечить асептическое извлечение содержимого;
f) достижение параметров стерилизации;
g) достижение параметров сушки.
Кроме оценивания закрытых барьерных систем для стерилизации необходимо открыть упаковку и оценить на соответствие документированной процедуре сборки.
Примечание - Можно использовать контрольный лист OQ, приведенный в приложении Е, Е.2.
3.3.2.8.3 Аттестация эксплуатации оборудования (квалификация эксплуатации PQ)
Аттестация PQ показывает, что процесс обертывания последовательно производит приемлемые барьерные системы для стерилизации в установленных рабочих условиях:
a) оценивание барьерной системы для стерилизации проводят после того, как она закрыта и стерилизована;
b) документация на партии, использованные в ходе валидационных исследований, образует часть записей о валидации. Идентификация партии должна включать (но этим не ограничиваться) следующее:
1) оператора;
2) время и дату;
3) процесс стерилизации, параметры и число циклов;
4) использованные материалы барьерной системы для стерилизации;
5) использованную ленту для склеивания;
6) содержимое барьерной системы для стерилизации;
c) три партии образцов стерилизуют с помощью одного и того же процесса тремя отдельными циклами, чтобы продемонстрировать воспроизводимость;
d) следует собрать три партии или набора закрытых барьерных систем для стерилизации в соответствии с документированными процедурами медицинского учреждения. Эти три партии включают потенциально значимые источники изменчивости, такие как оператор, время суток, материал (размер, источник, контролируемая партия), содержимое барьерных систем для стерилизации. Следует также включить содержимое упаковки, которое представляет наибольшую проблему (наихудший случай). Если барьерную систему для стерилизации многократного применения подвергают стерилизации разными процессами или многократной стерилизации, чтобы достичь финишной стерилизации, валидация должна охватывать все процессы в порядке выполнения. Повторное использование барьерных систем для стерилизации, предназначенных для однократного использования недопустимо;
е) образцы заклеивают/закрывают и оценивают. Все образцы должны соответствовать критериям приемки. Руководство по размеру выборки см. в 3.3.2.2, перечисление h);
f) в зависимости от методов, используемых для оценивания закрытия, следует подготовить несколько наборов на партию;
g) барьерные системы для стерилизации оценивают после стерилизации и после ожидаемых наименее благоприятных условий обращения, распределения и хранения до места использования, используя критерии приемки из OQ. Результаты документируют.
Примечание - Для документации можно использовать контрольный лист для PQ из приложения G, G.2.
3.3.2.9 Валидация процесса помещения в контейнер (наполнение и закрытие контейнеров многократного применения)
ИСО 11607-2 и данное руководство рассматривают наполнение и закрытие контейнеров многократного использования; в то же время не рассматривается очистка или обеззараживание этих контейнеров перед повторным использованием. В реальной больничной ситуации контейнеры многократного использования подвергают установленным и валидированным процессам очистки/обеззараживания перед наполнением и закрытием.
При выполнении валидации процессов, использующих контейнеры многократного использования, важно убедиться, что инструкции изготовителя выполняются и документируются для каждого контейнера, использованного в валидации (например, состояние корзинки-вкладыша, самого контейнера и т.д.).
3.3.2.9.1 Аттестация монтажа
Хотя наполнение и закрытие контейнеров - это типично ручная работа, рассматривают такие аспекты IQ: условия окружающей среды, такие как чистота помещения, температура и влажность; документированное/выполняемое обучение; рабочие инструкции или справочники. Если используется оборудование, то IQ следует выполнять в соответствии с ИСО 11607-2:2006, пункт 5.2.
3.3.2.9.2 Аттестация эксплуатации
Должны быть разработаны и документально оформлены процедуры оценивания повреждений, наполнения и закрытия контейнеров. Эти процедуры должны учитывать 3.2.2.3 и 3.2.2.6.4. Подробное описание следует получить от изготовителя.
Операторы должны пройти подготовку и оценку компетенции. SOP должны быть утверждены в письменной форме до начала аттестации.
Контейнеры промывают и проверяют, загружают и закрывают с помощью системы контроля вскрытия в соответствии с инструкциями изготовителя и документированной процедурой медицинского учреждения. При определении или выборе содержимого этих контейнеров следует включить наихудший вариант конфигурации, т.е. контейнер загружают в соответствии с массой, объемом и материалом. Также следует включить барьерные системы для стерилизации, в которых проведена обычная регулировка, например замена фильтров оператором. Все образцы должны соответствовать критериям приемки. Для руководства по объему выборки см. 3.3.2.2, перечисление h). Для аттестации OQ образцы можно собирать на однократную оценку или производить несколько загрузок в один и тот же контейнер, в зависимости от условий использования. В зависимости от используемых для оценки закрытия методов испытания следует подготовить по нескольку наборов на партию.
Барьерные системы для стерилизации в сборе следует оценивать на целостность системы и надлежащее закрытие. Приемочные критерии должны включать, но не ограничиваться этим, проверку следующего:
a) соприкасающихся поверхностей клеевого соединения и кромок системы контейнер-крышка, чтобы обеспечить отсутствие вмятин и сколов;
b) чтобы механизмы фиксации фильтров и крепежные приспособления, такие как винты и заклепки, были безопасны, без перекосов и заусенцев;
c) чтобы предохранительные механизмы функционировали надлежащим образом;
d) чтобы не была нарушена целостность фильтровальной среды;
e) чтобы прокладки были гибкими, надежно закрепленными, без разрывов и разрезов;
f) чтобы клапаны работали свободно;
g) целостности и непрерывности закрытия;
h) отсутствия повреждений фильтров, механических элементов клапанов или нарушений подачи стерилизующего средства;
i) возможности вскрытия контейнера без повреждения содержимого;
j) чтобы контейнер можно было вскрыть и извлечь содержимое, не нарушая асептики;
k) целостности и эффективности механизма контроля вскрытия;
l) чтобы параметры стерилизации были достигнуты;
m) чтобы параметры сушки были достигнуты.
В дополнение к оцениванию барьерных систем для стерилизации рекомендуется открыть контейнеры и оценить на соответствие документально подтвержденной части процедуры сборки: очистки, контроля и загрузки.
Примечание - Можно использовать контрольный лист OQ из приложения F, F.3.
3.3.2.9.3 Аттестация эксплуатации оборудования
Изготовитель контейнера должен представить доказательства совместимости контейнера с установленным процессом стерилизации и способности стерилизованного контейнера поддерживать стерильность своего содержимого. Аттестация PQ демонстрирует, что процесс загрузки, наполнения и закрытия в обязательном порядке создаст приемлемую барьерную систему для стерилизации в установленных условиях эксплуатации.
После того как барьерная система для стерилизации закрыта и стерилизована, рекомендуется провести ее оценку. При этом необходимо рассмотреть следующее:
a) документация на партию для партий, использованных во время валидационных исследований, должна быть включена в записи о валидации. Идентификация партии включает (не ограничиваясь этим) следующее:
1) идентификацию оператора;
2) дату и время;
3) процесс стерилизации, параметры и число циклов;
4) материалы использованной барьерной системы для стерилизации;
5) используемую систему контроля вскрытия;
6) содержимое барьерной системы для стерилизации;
b) в соответствии с документированными инструкциями медицинского учреждения собирают три партии или набора закрытых барьерных систем для стерилизации. Эти три партии должны включать потенциальный значимый источник изменчивости, такой как оператор, время суток, материал (размер, источник, контрольная партия), содержимое барьерной системы для стерилизации. Рекомендуется использовать содержимое, которое представляет наибольшие проблемы (наихудший случай). Если одна и та же барьерная система для стерилизации предполагается для использования в различных процессах стерилизации, каждая подлежит валидации;
c) все образцы должны соответствовать критериям приемки. В отношении размера выборки см. 3.3.2.2, перечисление h);
d) барьерные системы для стерилизации следует оценить после прохождения процесса стерилизации и после наихудшего варианта обращения, распределения и условий хранения вплоть до места использования, по критериям приемки из OQ. Кроме критериев приемки из OQ содержимое оценивают после стерилизации, чтобы обеспечить достаточную сушку после процесса паровой стерилизации;
e) три партии образцов подвергают одинаковому процессу стерилизации в трех разных циклах, чтобы продемонстрировать воспроизводимость;
f) все результаты оценивания документируют.
Примечание - Для документирования можно использовать контрольный лист PQ из приложения G, G.3;
g) в случае выявления нарушений в упаковке следует провести расследование для идентификации основной причины этого (см. приложение R).
3.4 Система качества ИСО 11607-1:2006, пункт 4.2, и ИСО 11607-2:2006, пункт 4.2, требуют внедрения официальной системы качества, но не дают дополнительных указаний.
4 Руководство для промышленности
4.1 Общее руководство 4.1.1 Системы качества 4.1.1.1 Применение ИСО 11607-1 следует осуществлять в рамках официальной системы (обеспечения) качества (ИСО 11607-1:2006, пункт 4.2).
4.1.1.2 Критическим элементом этой системы качества является контроль проектирования. Процедуры контроля проектирования предназначены для обеспечения соответствия конструкции упаковочной системы и любых модификаций или пересмотров проекта установленным требованиям к конструкции ИСО 11607-1:2006, подпункт 6.2.1.
Дополнительную информацию по разработке установленных требований к конструированию см. в 4.3 и приложении J о проектных заданиях.
4.1.1.3 Архив проектной документации обычно содержит документацию о процессе разработки упаковочной системы и всех последних модификаций или пересмотров (ИСО 11607-1:2006, пункт 4.5 и подпункт 6.2.5).
4.1.1.4 Фундаментальным требованием большинства систем качества является менеджмент риска. Проводят официальный анализ риска, чтобы определить возможные отказы, которые могут произойти в процессе упаковывания, и их влияние на безопасность и эффективность медицинского изделия. Ключевым требованием является проектирование упаковочной системы с учетом сведения к минимуму опасности для пациента и пользователя в предполагаемых условиях использования (см. ИСО 11607-1:2006, подпункт 6.1.1). ИСО 14971 описывает требования и применимость оценки риска в рамках области применения медицинских изделий. Инструменты проведения анализа риска описаны в приложении К.
4.1.1.5 Для ссылок на регламентные ограничения, контроль проектирования и аспекты системы качества см. приложение N.
4.1.2 Методы испытаний ИСО 11607-1 и ИСО 11607-2 требуют валидировать все методы испытания, использующиеся для демонстрации соответствия настоящему стандарту (см. приложение О). Для руководства по требованиям к методам испытаний, описанным в ИСО 11607-1 и ИСО 11607-2, см. приложение А данного документа.
Методы испытания, которые подверглись систематическим межлабораторным исследованиям, являются предпочтительными, поскольку определены их повторяемость (сходимость), воспроизводимость и в некоторых случаях чувствительность. При внедрении таких методов в конкретную лабораторию важно продемонстрировать, что точность и повторяемость метода по крайней мере не хуже воспроизводимости из межлабораторных исследований.
Можно использовать методы испытаний, разработанные независимо или по научной литературе. В то же время важно определить, насколько разработанный метод удовлетворяет требуемой чувствительности, а точность и повторяемость удовлетворяли предварительно определенным критериям.
4.1.3 Отбор проб
Планы выборочного контроля следует применять к упаковочным системам, отражающим рискоустойчивость, и основываться на статистически достоверном обосновании (ИСО 11607-1:2006, пункт 4.3). См. 4.8.2 и приложение I, I.4, для дополнительной информации.
4.2 Проектные задания Перед тем как рассматривать материалы и/или конструкцию упаковочной системы, следует разработать комплект проектных заданий (ИСО 11607-1:2006, подпункты 6.2.2 и 6.2.3). Они будут использованы при оценивании материалов и/или конструкции.
Проектные задания будут отражать потребности пользователя. Эта информация будет поступать от пользователей и касаться технических, производственных, маркетинговых, регламентных и других вопросов. Некоторые примеры проектных заданий представляют особенности медицинских изделий, требования к защите медицинских изделий, конфигурацию продажных единиц, процесс стерилизации, распределение, обращение и среду использования (ИСО 11607-1:2006, пункты 6.1 и 6.2).
Примечание - Руководство по разработке проектных заданий см. в приложении J.
4.3 Выбор и оценивание материалов Примечание - Информацию по этим темам можно найти в приложении А.
4.3.1 Руководство по требованиям к стерилизации ([ИСО 11607-1:2006, подпункт 5.1.6, перечисление f), и пункт 5.3] При оценивании характеристик материала, имеющих значение для медицинского изделия, процесса и конечного использования, важно помнить, что материал должен обладать характеристиками, подходящими для процесса стерилизации (например, пористостью для стерилизации газом), а также способностью выдерживать условия процесса стерилизации. Дополнительную информацию по стерилизации см. в приложении В.
4.3.2 Руководство по требованиям к безопасности (ИСО 11607-1:2006, подпункты 5.1.5 и 5.1.6) При выборе материалов для барьерной системы для стерилизации существуют базовые требования к безопасности, которые должны выполняться. История происхождения и прослеживаемость материалов должны быть известны и под контролем. Следует оценить химические свойства. Сюда обычно входят токсичность и оценка возможных химических взаимодействий между материалом и медицинским изделием. Часто сюда включают испытания на присутствие токсичных тяжелых металлов. Дополнительную информацию см. в приложении А.
4.3.3 Руководство по требованиям к защите (стерильности) (ИСО 11607-1:2006, подпункты 5.1.4 и 5.1.6) Требования к защите стерильности медицинского изделия и выбранный метод стерилизации помогут определить подходящие материалы для барьерной и упаковочной систем. Можно использовать различные методы для оценки характеристик материалов и барьера или уровней защиты, требуемых для защиты (стерильности) медицинского изделия. Некоторые рассматриваемые свойства включают пористость, микробный барьер, влажность воздуха (кислорода), содержание влаги, температуру и светопропускание. Эти свойства описаны в разделе по барьерам приложения А.
4.3.4 Руководство по требованиям к возможности визуального контроля и внешнему виду Требования к возможности визуального контроля и внешнему виду, если применяются, будут определяться желаемой эстетикой (например, барьерная система для стерилизации с глянцевой или матовой поверхностью), подходом к этикетированию (например, вставленная внутрь этикетка может потребовать хорошей прозрачности барьерной системы для стерилизации) и желанием видеть (или, наоборот, скрыть) изделие. Рассматривают замутненность, блеск, непрозрачность, прозрачность. Дополнительную информацию см. в приложении А.
4.3.5 Руководство по требованиям к физическим свойствам [ИСО 11607-1:2006, подпункты 5.1.6, перечисление с), 5.1.7, перечисление е), и 6.3.2] Барьерная система для стерилизации должна обладать способностью защищать стерильность медицинского изделия, его эффективность и/или функциональность до момента использования. Требования к физическим свойствам барьерной системы для стерилизации или предварительно сформированной барьерной системы для стерилизации будут зависеть от массы и профиля содержимого, типа защитной упаковки (если применяется), условий хранения и системы распределения. Существуют факторы, которые влияют на характеристики материала. Примеры включают сопротивление проколу, истиранию и разрыву, прочность на изгиб, толщину и основную массу. Эти факторы подробно описаны в приложении А. Методы оценивания физических свойств характеризуют материал, но при этом не могут напрямую спрогнозировать характеристики готовой барьерной системы для стерилизации, и зачастую требуется дополнительная оценка, такая как лабораторные испытания характеристик модели упаковочной системы, чтобы оценить характеристики материалов для барьерной системы для стерилизации под конкретное медицинское изделие.
4.3.6 Руководство по требованиям к термосвариваемости [ИСО 11607-1:2006, подпункты 5.1.6, перечисление d), и 5.1.8, перечисление с)] Клеевые соединения испытывают на прочность на отрыв при растяжении и анализируют, насколько полученные результаты удовлетворяют желательной прочности клеевого соединения для барьерной системы для стерилизации. Другие критерии включают возможность вскрытия посредством снятия слоя, визуальные качества клеевого соединения и разрушение материала при вскрытии. Испытание на растяжение клеевого соединения обычно используют как инструмент скрининга (сортировки), чтобы выбрать сочетания материалов, а также для оценки термошвов до и после стерилизации. Можно использовать ряд различных методов испытания на прочность клеевых соединений. См. ИСО 11607-1, приложение В. ASTM F88 описывает ряд этих методов и включает информацию о влиянии различий в технике их исполнения.
4.3.7 Руководство по требованиям к обработке (ИСО 11607-1:2006, подпункты 5.1.2-5.1.9) Поскольку упаковочные материалы оценивают на совместимость с оборудованием и условиями обработки, необходимо уделить внимание предварительно определенным требованиям, которые обеспечивают последовательное и надежное производство барьерных систем для стерилизации. Общие методы, использующиеся для оценки требований к процессу и условиям - это измерение размеров, коэффициента требования (COF), термосвариваемости и массы покрытия. Более подробно они обсуждаются в приложении А.
4.3.8 Руководство по требованиям к печати (маркировка) (ИСО 11607-1:2006, пункт 5.4) Важно иметь в виду особенности упаковочных материалов при проектировании печати. Размеры и стили шрифтов могут не подходить к конкретным материалам, также следует рассмотреть цвет краски, расположение графики и копирование. При оценивании новых поверхностей под маркировку необходимо учитывать способность к печати. Свойства типографской краски должны гарантировать физическую и химическую стойкость к разложению и сохранение функции напечатанных индикаторов процесса для предполагаемого воздействия или процессов стерилизации. Следует обдумать, когда наносить графическую печать - до и/или после формирования, чтобы гарантировать, что внешний вид графики существенно не пострадает и нанесенная информация не превратится в нечитабельную. Дополнительную информацию по оцениванию материалов для конкретных требований к печати см. в приложении А.
4.3.9 Руководство по требованиям к чистоте и наличию твердых частиц [ИСО 11607-1:2006, подпункт 5.1.7, перечисление d)] В обычные требования к чистоте входит отсутствие грязи, пыли, смазки и других форм загрязнения. Частицы могут быть слипшимися или рыхлыми, инородными или от основного материала. Дополнительную информацию по частицам см. в приложении А. Приемлемый уровень частиц, присутствующих на материале, будет зависеть от выбранного материала. Размер частиц часто оценивают по карте оценки загрязнения (TAPPI Dirt Estimation Chart).
4.3.10 Взаимодействие упаковываемого изделия с упаковкой
На использование медицинского изделия могут повлиять жесткость, липкость, обесцвечивание материала и другие его качества.
Компоненты барьерной системы для стерилизации могут мигрировать в медицинское изделие (вымываемые вещества) и взаимодействовать с его компонентами, что приводит к неблагоприятным последствиям. Таким же образом компоненты материалов медицинского изделия могут мигрировать в упаковочную систему и приводить к неблагоприятным последствиям. Необходимо оценить риск и изучить совместимость по обстоятельствам.
4.4 Проектирование барьерной системы для стерилизации и защитной упаковки (разработка упаковочной системы) 4.4.1 Ключевые элементы проекта Для проектирования и разработки барьерной системы для стерилизации и защитной упаковки используют документированные процедуры (ИСО 11607-1:2006, подпункт 6.2.1).
Ключевым компонентом процесса проектирования упаковочной системы являются сбор и оценка проектных заданий (ИСО 11607-1:2006, подпункты 6.2.2 и 6.2.3), которые предварительно были описаны в 4.3 и приложении J.
Функцию разработки упаковки следует включить в процесс или систему контроля проектирования. Процесс проектирования упаковочной системы для медицинского изделия, подлежащего финишной стерилизации, следует начинать на самой ранней стадии общего цикла разработок для медицинского изделия. Важно участвовать в процессе разработки медицинского изделия и четко понимать все, что касается этого медицинского изделия, включая соответствующие технические условия на медицинское изделие, стерилизацию и производство.
Проектирование барьерной системы для стерилизации и защитной упаковки (т.е. упаковочной системы) можно осуществить совместно с упаковочным предприятием. Руководство по использованию упаковочных предприятий см. в приложении Р.
4.4.2 Этапы проектирования упаковочной системы
4.4.2.1 Проектирование барьерной системы для стерилизации
4.4.2.1.1 Целью процесса проектирования упаковки являются барьерная система для стерилизации, которая позволяет стерилизовать и поддерживать стерильность медицинского изделия до места использования или даты окончания срока годности, а также извлечение медицинского изделия, не нарушая асептики в месте использования (ИСО 11607-1:2006, пункты 6.1 и 6.2).
4.4.2.1.2 Выбирают тип барьерной системы для стерилизации и материалы конструкции на основе данных (проектных заданий), собранных в процессе участия в разработке медицинского изделия. Ниже следуют традиционные типы барьерных систем для стерилизации и типы предварительно сформированных барьерных систем для стерилизации:
a) предварительно сформированный лоток с крышкой (ИСО 11607-1:2006, приложение А, пункт А.3.2):
b) предварительно сформированный пакет (ИСО 11607-1:2006, приложение А, пункт А.3.3);
c) предварительно сформированный пакет для стерилизации (ИСО 11607-1:2006, приложение А, пункт А.3.4);
d) предварительно сформированный пакет, запечатываемый этикеткой, перегнутой пополам (ИСО 11607-1:2006, приложение А, пункт А.3.5);
e) контейнеры многократного использования (ИСО 11607-1:2006, приложение А, пункт А.3.12);
f) изолированные свертки с закрытием извилистого профиля (ИСО 11607-1:2006, приложение А, пункт А.3.11);
g) требующие изготовления барьерной системы для стерилизации и выполнения всех клеевых соединений - формирование/наполнение/склеивание и заклеивание по четырем сторонам (ИСО 11607-1:2006, приложение А, пункты А.3.6 и А.3.7).
4.4.2.1.3 Устанавливают и документируют материалы, размеры, допуски, геометрию и физические характеристики барьерной системы для стерилизации в соответствии с процедурами, предусмотренными системой качества.
Примечание - Необходимо установить допуски, реальные с точки зрения возможностей поставщика и используемого оборудования.
4.4.2.2 Проектирование защитной упаковки
Защитная упаковка обеспечивает физическую защиту барьерной системы для стерилизации и ее содержимого.
Устанавливают и документируют материалы, размеры, геометрию и физические характеристики в соответствии с процедурами, предусмотренными системой качества.
4.4.2.3 Прототип упаковочной системы
a) Если оценка прошла успешно, переходят к проверке технической реализуемости (осуществимости проекта);
b) Если прототип упаковочной системы неприемлем, возвращаются на стадию проектирования.
Примечание - Руководство по испытаниям реализуемости проектирования упаковочных систем см. в приложении S, S.2.
4.4.2.4 Проблемы этикетирования для проектирования упаковочных систем
Примечание - Проектирование и графическая печать этикеток являются критическим моментом и трудоемкой деятельностью при изготовлении медицинских изделий. Воспроизводимость для задания содержания этикетки обычно зависит не только от упаковочной бригады или места исполнения. Гарантирование, что упаковочная система снабжена должной маркировкой, обычно лежит на ответственности упаковочной бригады или места исполнения.
4.4.2.4.1 Готовая система маркировки должна оставаться нетронутой и удобочитаемой вплоть до места использования (медицинского изделия), быть совместима со всеми материалами и процессами и не переноситься на медицинское изделие, не вступать в реакцию с медицинским изделием, нарушающую практическое значение упаковочной системы.
4.4.2.4.2 Определяют, будет выполняться маркировка печатью непосредственно на упаковочных материалах или прикреплением этикетки (бирки) к упаковочной системе.
4.4.2.4.3 Если используются бирки, необходимо установить размеры вырезаемого цветного лоскута для бирки, материалы, покрытия и клеи.
4.4.2.4.4 Если используются бирки, определяют, где будет произведена печать: предварительно или в месте производства изделия.
4.4.2.4.5 Устанавливают тип печати. Типы печати включают (но этим не ограничиваются) лазерную печать, струйную печать и термоперенос.
4.4.2.4.6 При необходимости устанавливают систему печати переменных данных на этикетках для медицинских изделий. Переменные данные включают (но этим не ограничиваются) номер партии или серийный номер, дату изготовления и дату окончания срока годности.
4.4.2.4.7 Включают в проект упаковочной системы инструкцию по применению (IFU) и список литературы на медицинское изделие.
4.5 Оценка реализуемости процесса упаковывания Примечание - Реализуемость не является требованием ИСО 11607-1 или ИСО 11607-2. Этот раздел используется для оценки реализуемости упаковочной системы.
4.5.1 Процесс производства барьерной системы для стерилизации Определяют процесс производства для выбранной барьерной системы для стерилизации. Разрабатывают технологическую карту или блок-схему процесса изготовления. Показывают каждую стадию процесса изготовления, загрузки, склеивания и упаковывания. На каждой стадии анализируют потенциальные риски отказа барьерной системы для стерилизации или упаковочной системы, а также источник изменчивости, который может привести к проблемам качества. Оценивают риски, принимают решение о возможностях контроля и повторного проектирования процесса упаковывания соответственно (для руководства см. приложение К). Указывают материал упаковочной системы и движение медицинского изделия. Руководство по подробному анализу см. в приложении S. Руководство по определению параметров процесса см. в приложении Q.
4.5.2 Руководство по аттестации монтажа оборудования Определяют требования IQ оборудования для каждой комбинации аппарат/стадия, определенной на технологической карте или блок-схеме. См. ИСО 11607-2:2006, пункт 5.2 для обсуждения IQ, а также 4.8.
a) При использовании существующего оборудования определяют, будет использовано новое или уже работающее оборудование и соответственно оценивают IQ.
b) При использовании нового оборудования выполняют IQ.
4.5.3 Испытания опытных образцов
Для начального эксплуатационного испытания рекомендуется изготовить опытную упаковку, поскольку это снижает риск отказа в ходе валидации процесса упаковывания.
Опытные образцы барьерных систем для стерилизации следует изготавливать, используя параметры процесса, которые будут использоваться в эксплуатационных испытаниях барьерной системы для стерилизации.
4.6 Оценка реализуемости проектирования барьерной системы для стерилизации 4.6.1 Общие проблемы 4.6.1.1 Это техническая оценка, в ходе которой барьерная система для стерилизации (или только ее опытный образец на этом этапе) подвергается испытаниям. Результаты испытаний определяют, стоит ли запускать проект.
4.6.1.2 С помощью таких испытаний обычно оценивают:
a) защищает ли барьерная система для стерилизации содержащееся в ней медицинское изделие от физического повреждения;
b) возможные взаимодействия между барьерной системой для стерилизации и ее содержимым.
4.6.1.3 Тогда как этот этап зачастую не является полноценной валидацией, полезные указания можно найти в приложении I, описывающем составление протокола валидации стерилизационной упаковки (конечной упаковочной системы).
4.6.2 Метод испытания барьерной системы для стерилизации 4.6.2.1 Используют документированный план испытаний, включающий прошедшие валидацию методы испытаний (ИСО 11607-1:2006, подпункт 6.3.2). См. приложение А для дополнительной информации по методам испытания.
4.6.2.2 Этот план должен включать критерии "пройдено-не пройдено".
4.6.2.3 Испытания барьерных систем для стерилизации следует проводить на образцах, сконструированных с учетом элементов наихудшего случая, идентифицированного в 4.6.3 (ИСО 11607-1:2006, подпункт 6.3.4).
4.6.2.4 Образцы следует подвергнуть динамическим испытаниям, которые имитируют ожидаемую среду распределения (ИСО 11607-1:2006, подпункт 6.3.5).
4.6.3 Наихудший вариант условия реализуемости Примечание - Дополнительное руководство по наихудшему варианту см. в приложении Н.
Чтобы правильно определить реализуемость, определяют наихудшие условия или то, что в данной точке процесса считается наихудшим случаем, для ряда факторов, связанных с упаковочной системой. Сюда входит (но этим не ограничивается) следующее:
a) производство барьерной системы для стерилизации (параметры склеивания и т.д.);
b) процесс стерилизации (параметры, число циклов и т.д.): для начальных испытаний реализуемости стерилизация образцов может не потребоваться;
c) конфигурация отправки: требуется понимание, каким образом медицинское изделие будет отправляться потребителю;
d) оборудование для распределения: требуется понимание, каким образом медицинское изделие будет отправляться потребителю;
e) испытание срока годности обычно не требуется на этом этапе, однако можно использовать ускоренное старение. Испытание на ускоренное старение позволяет имитировать влияние времени на упаковочную систему, подвергая полностью обработанную защитную упаковочную систему воздействию высоких температур в контролируемой среде. Реальное время обычно оценивают, предполагая, что разложение упаковочных материалов происходит в соответствии с кинетикой, описанной законом Аррениуса о зависимости скорости химической реакции от температуры. Дополнительное руководство см. в ИСО 11607-1:2006, приложение В.
4.6.4 Статус упаковочной системы "пригодна-непригодна"
4.6.4.1 По завершении испытаний определяют, удовлетворяет ли упаковочная система приемочным критериям испытаний реализуемости.
4.6.4.2 Упаковочная система проходит испытание осуществимости, если удовлетворяет критериям, установленным планом испытания. Таким образом убеждаются, что проектируемая конструкция будет работать. Начинают подготовку к валидации упаковочной системы, обычно проводимой на прошедшем валидацию процессе производства, как в 4.7.
4.6.4.3 Если упаковочная система не соответствует всем установленным в плане испытаний критериям, вид отказа следует определить и расследовать. Следует предпринять корректирующие действия в отношении отказов. Сюда могут входить пересмотр концепции и повторное испытание реализуемости. Руководство по определению вида отказа и соответствующего корректирующего действия см. в приложении R.
4.7 Валидация процесса производства барьерной системы для стерилизации Валидация барьерной системы для стерилизации часто означает включение дополнительных функциональных элементов изготовителем медицинских изделий и/или упаковочными предприятиями и поставщиками упаковки. Для предварительно сформированных барьерных систем для стерилизации процесс упаковывания медицинского изделия часто ограничивается вкладыванием и герметичным закрытием барьерной системы для стерилизации. В данном случае применяется метод "формирование - наполнение (вкладывание медицинского изделия) - заклеивание". Обычно упаковочное предприятие выполняет валидацию формирования барьерной системы для стерилизации и закрытия после вкладывания медицинского изделия. Рекомендуется анализировать данное руководство вместе с ИСО 11607-2.
4.7.1 Подготовка письменного протокола валидации процесса 4.7.1.1 Протокол валидации может быть написан для семейства барьерных систем для стерилизации. Обоснование для определения семейств оцениваемых барьерных систем для стерилизации должно подтверждаться документально.
4.7.1.2 Часто имеются исторические данные на конкретные комбинации материалов. Следует оценить эти данные, чтобы определить их пригодность для использования. Обоснование документируют.
4.7.1.3 Деятельность IQ необходимо спланировать и оформить документально. Если аттестация IQ предварительно выполнена для рассматриваемого оборудования, эту работу следует оценить, чтобы определить, насколько она удовлетворяет потребностям текущего мероприятия по валидации.
4.7.1.4 Деятельность OQ необходимо спланировать и оформить документально. Необходимо подробно описать критерии приемки. Такие заранее определенные требования включают размеры, прочность клеевого соединения, целостность клеевого соединения, особенности вскрытия и целостность материала.
4.7.1.5 Деятельность PQ необходимо спланировать и оформить документально. Необходимо подробно описать критерии приемки. Такие заранее определенные требования включают размеры, прочность клеевого соединения, целостность клеевого соединения, особенности вскрытия и целостность материала.
4.7.1.6 Протокол валидации процесса должен быть проанализирован и утвержден соответствующими работниками.
4.7.2 Выполнение мероприятий по валидации, описанных в протоколе 4.7.2.1 Аттестация монтажа (если не удовлетворили результаты предварительной работы по IQ) (ИСО 11607-2:2006, пункт 5.2)
Аттестация IQ может включать следующие действия:
a) разработка маршрутной карты монтажа:
- особенности конструкции оборудования;
- условия монтажа;
- аспекты безопасности;
- документация поставщика, печать, чертежи и справочники;
- перечень запасных частей;
b) подтверждение работы оборудования в соответствии с расчетными параметрами;
c) выполнение валидации компьютерных программ;
d) установление условий окружающей среды;
e) разработка и утверждение типовых рабочих инструкций (SOP) для эксплуатации оборудования и документирования программы обучения операторов;
f) подтверждение контроля и мониторинга критических параметров процесса, таких как:
- температура;
- давление или давление по манометру;
- пауза (перед новым циклом);
g) разработка планов и процедур калибровки;
h) разработка планов и процедур профилактического обслуживания и чистки.
4.7.2.2 Аттестация эксплуатации (ИСО 11607-2:2006, пункт 5.3)
4.7.2.2.1 Выполняют технические исследования для создания области эффективных режимов в наиболее неблагоприятном случае. Обычно это экстремумы области эффективных режимов (например, наименьшая и наибольшая температура, наименьшее и наибольшее давление, минимальная и максимальная пауза). Эту область следует оценить для подтверждения, что она соответствует возможностям процесса. Сделанные заключения документируют.
4.7.2.2.2 Образцы, произведенные в условиях наихудшего варианта, необходимо включить в протокол эксплуатационных испытаний, который гарантирует валидацию всего технологического окна (см. ИСО 11607-1:2006, подпункт 6.3.4 и приложение Н). Образцы для проведения аттестации эксплуатационных характеристик можно сконструировать в ходе OQ, если они производятся в условиях, подтвержденных в ходе PQ.
Примечание - Дополнительное руководство по наихудшему варианту условий см. приложение Н.
4.7.2.2.3 Проверяют, чтобы все контрольные меры, определенные в процессе менеджмента риска, были согласованы и работали эффективно.
4.7.2.2.4 Проверяют, чтобы барьерная система для стерилизации, произведенная при экстремальных параметрах процесса, надежно удовлетворяла критериям приемки, определенным в протоколе.
4.7.2.3 Аттестация эксплуатируемого оборудования (ИСО 11607-2:2006, пункт 5.4)
Обычно проводят аттестацию трех успешных промышленных серий. Эти серии производятся в нормальных рабочих условиях и могут прерываться другими производственными процессами на рассматриваемом оборудовании. В то же время все три промышленные серии для PQ должны быть успешны без отказов в промежуточных сериях. Необходимо рассмотреть достаточный период времени и влияние перехода с режима на режим, перерывов и многосменного режима работы. Подтверждают, что произведенная барьерная система для стерилизации удовлетворяет критериям приемки, определенным в протоколе.
4.7.3 Оценка результатов валидации Оценивают результаты валидации (ИСО 11607-2:2006, подпункт 5.4.7). Оценивают деятельность, описанную в 4.7.2, чтобы подтвердить соответствие критериям приемки, описанным в 4.7.1.4 и 4.7.1.5. Любые отклонения от протокола необходимо документировать, анализировать и оценивать, чтобы определить выполнение намерений протокола.
4.7.4 Утверждение валидации процесса Валидация процесса требует анализа и утверждения соответствующими работниками (ИСО 11607-2:2006, пункт 5.5).
4.7.5 Организация документально оформленного контроля и мониторинга текущего процесса
Организуют документированный текущий контроль и мониторинг процесса (ИСО 11607-2:2006, пункт 5.6). Обычно сюда включают:
a) мониторинг и регистрацию критических параметров процесса;
b) контроль в ходе процесса барьерных систем для стерилизации в соответствии с системой качества.
Примечание - Выбранные мониторы должны подходить для мониторинга процесса. Используют данные и знание процесса для выбора мониторов, подходящих для контролируемого процесса в соответствии с требованиями системы качества.
4.8 Валидация конструкции упаковочной системы 4.8.1 Общие положения Валидация конструкции упаковочной системы (ИСО 11607-1:2006, пункты 6.3 и 6.4) включает:
a) составление протокола валидации, который представляет собой план испытаний упаковочной системы;
b) выполнение кондиционирования и испытаний, определенных протоколом;
c) оценку соответствия результатов испытаний приемочным критериям, установленным в протоколе;
d) получение официального утверждения валидации.
4.8.2 Протокол валидации Протокол валидации должен включать подробные данные по следующим предметам:
a) ставят плановые цели, которые могут включать просмотр физических испытаний, если барьерная система для стерилизации сохранила свою целостность после событий жизненного цикла, таких как стерилизация, испытание имитированного распределения упаковочной системы и испытание стабильности. Альтернативно испытание стабильности можно выполнить во время части испытания реализуемости проектной деятельности. Его следует проводить отдельно.
Примечание - Методы микробиологических испытаний могут потребоваться для исследования извилистого пути закрытия;
b) составляют подробное описание и технические требования к упаковочной системе в отношении барьерной системы для стерилизации и любых дополнительных слоев защитной упаковки. Обеспечивают контроль технических условий перед окончательной доработкой протокола испытания.
Если используют одну и ту же барьерную систему для стерилизации для разных медицинских изделий или семейства медицинских изделий, тогда следует подготовить обоснование, показывающее, что другие медицинские изделия, помещенные в такую же упаковку, представляют менее серьезную проблему, чем конкретная конфигурация, подлежащая валидации;
c) разрабатывают план выборочного контроля для применения: размер выборки должен быть достаточно большим, чтобы обеспечить статистически значимый анализ и получить более высокую степень надежности, при этом он будет зависеть от политики минимизации корпоративного риска, экономики и регламентных требований. Дополнительное руководство см. в приложении I, I.4.
Упаковочную систему готовят следующим образом:
- барьерную систему для стерилизации, которая используется в испытуемой упаковочной системе, изготавливают в соответствии с прошедшим валидацию процессом или процессом, который готов к валидации. Образцы для испытаний должны быть такими же или эквивалентными изготовленным в соответствии с прошедшим валидацию процессом;
- барьерную систему для стерилизации или упаковочную систему стерилизуют в конфигурации медицинское изделие/упаковка, причем процесс стерилизации прошел валидацию. Если установлено в технических условиях, процесс стерилизации можно выполнить многократно, чтобы создать условия наихудшего случая;
- упаковочные системы, подлежащие испытанию, должны содержать барьерную систему для стерилизации с медицинскими изделиями или суррогатом медицинского изделия внутри, маркировку, инструкцию по использованию (IFU) и все дополнительные слои упаковки;
d) определяют режим ускоренного старения, обсуждение которого см. в приложении I, I.8, и приложении А, А.12, а испытание стабильности см. в приложении М;
e) определяют выполнение испытаний по обращению, распределению и хранению. Обсуждение см. в приложении I, I.7, и приложении А, А.12;
f) выбирают подходящие методы испытания для упаковочных систем. Руководство по методам испытания см. в приложении А;
g) разрабатывают критерии приемки на основе политики минимизации рисков и измеренного результата, такого как поддержание целостности барьерной системы для стерилизации, упаковочной системы и/или функциональности (упакованного в ней) медицинского изделия;
h) анализируют и утверждают всю документацию у соответствующих руководителей.
Дополнительное руководство по этим предметам см. в приложении I, описывающем разработку протокола валидации упаковочной системы.
4.8.3 Выполнение испытаний Испытания выполняют согласно протоколу. Любые отклонения от протокола следует документировать и представлять обоснование.
4.8.4 Документация результатов валидации Результаты испытаний сравнивают с критериями приемки, определенными протоколом, и оценку "пройдено-не пройдено" документируют.
Отчеты о валидации и собранные данные хранят в соответствии с требованиями системы качества. Последним этапом является официальное утверждение итогового отчета.
4.9 Повторная валидация (ревалидация) 4.9.1 Ревалидация требуется, когда внесены изменения в медицинское изделие, упаковочную систему, процесс или оборудование, что будет влиять на первоначальную валидацию. Среди примеров - изменения физических характеристик медицинского изделия, помещенного в барьерную систему для стерилизации; смена места проведения процесса, методов разработки или типа оборудования; смена изготовителя компонентов или используемой техники анализа (ИСО 11607-2:2006, пункт 5.7).
4.9.2 Вопросы ревалидации часто связаны с процедурами системы качества или с протоколом первоначальной валидации.
4.9.3 Ревалидация часто соединяется с контролем проектирования и соответствующей процедурой контроля изменений, объем выбранной ревалидации будет зависеть от характера изменений и их влияния на процесс или медицинское изделие. Дополнительную информацию по контролю проектирования см. в приложении N.
4.9.4 Периодически осуществляют анализ процесса, медицинского изделия, упаковочной системы, чтобы быть уверенным, что множество незначительных изменений и каждое из них в отдельности не требуют повторной валидации, а в сумме они не повлияли на упаковочную систему (ИСО 11607-2:2006, подпункт 5.7.4).
Приложение А (справочное)
Выбор, оценка и испытания упаковочных материалов и барьерных систем для стерилизации. Руководство для промышленных и медицинских учреждений А.1 Общие положения Выбор подходящего упаковочного материала для подлежащего стерилизации медицинского изделия требует тщательного рассмотрения и не должен совершаться в спешке (ИСО 11607-1:2006, пункт 5.1, раздел 6). Аспекты барьерной системы для стерилизации, которые необходимо учесть, включают совместимость со стерилизацией, защищенность в отношении отправки, обращения, барьерных свойств и ряда проблем, связанных с конечным использованием медицинского изделия. Наиболее целесообразно включить выбор материала упаковочной системы на ранней стадии процесса проектирования медицинского изделия. Откладывание такого важного вопроса до окончания проектирования может стать причиной задержки выпуска медицинского изделия на рынок или наложить ограничения на срок годности или привести к другим проблемам при использовании. Изготовители медицинской упаковки могут сыграть важную роль в определении подходящих вариантов.
Существуют методы испытаний, обеспечивающие для барьерных систем для стерилизации и/или упаковочных систем критерии оценки пригодности к использованию и средства мониторинга производственного процесса. Предпочтительно пользоваться методами испытаний, имеющими заявления о прецизионности и систематической погрешности (см. ИСО 11607-1:2006, приложение В). Не все методы испытаний подходят всегда и везде. При выборе метода испытаний руководствуются требованиями медицинского изделия на протяжении его жизненного цикла и выбирают такой метод, чтобы испытуемые свойства были тесно связаны со свойствами барьерной системы для стерилизации и/или упаковочной системы. Кроме того, некоторые методы больше подходят для исследования и развития, тогда как другие методы - для мониторинга соответствия. Приложение А не должно служить полным перечнем существующих методов испытаний, напротив, оно представляет собой обзор наиболее широко используемых методов и обоснование для их применения. Руководство по существующим методам испытаний см. в серии стандартов EN 868 или ASTM F2097, а также публикации Совета изготовителей упаковки для стерилизации [Sterilization Packaging Manufacturers Council (SPMC)] Ассоциации гибкой упаковки [Flexible Packaging Association (FPA)].
A.2 Совместимость с процессом стерилизации
A.2.1 Способность упаковочных материалов выдерживать процесс стерилизации и сохранять структурную целостность является особенно важным требованием к барьерной системе для стерилизации и/или упаковочной системе (ИСО 11607-1:2006, пункт 5.3 и подпункт 6.1.3). В результате метод(ы) стерилизации следует идентифицировать на ранней стадии.
А.2.2 Процессы стерилизации газом, такие как стерилизация на основе окиси этилена (ЕО-стерилизация), процессы паровой стерилизации и другие, требуют удаления воздуха и проникания стерилизующего средства через барьерную систему для стерилизации и/или упаковочную систему. Они также требуют условий повышенной температуры и влажности, с которыми выбранные материалы должны быть совместимы. Ввод и вывод стерилизующих газов также изменяет барьерную систему для стерилизации за счет изменения давления, поэтому требуется общая стойкость барьерной системы для стерилизации и/или упаковочной системы и адекватная свободная пористая зона барьерной системы для стерилизации и/или упаковочной системы как удобное место во всех дополнительных слоях упаковки, рассчитанное на расширение барьерной системы для стерилизации.
А.2.3 Тогда как изменение материала при ЕО-стерилизации зачастую пренебрежимо мало, другие методы, например стерилизация радиацией или газовой плазмой, могут стать причиной значительных изменений свойств материалов (см. AAMI TIR17).
А.2.4 Первоочередной задачей в части процесса выбора является оценка типа и количества предполагаемых циклов стерилизации, предпочтительно на конечной барьерной системе для стерилизации. Приложение С предлагает более детальный обзор методов стерилизации для облегчения выбора материала.
А.3 Проблемы безопасности
А.3.1 Большинство аспектов безопасности упаковочных материалов можно систематически отслеживать с помощью стандартных испытаний и сертификатов, полученных от поставщиков упаковки. Исключение составляет взаимодействие между материалом барьерной системы для стерилизации и медицинским изделием, которое наилучшим образом определит только изготовитель медицинского изделия.
А.3.2 Полная прослеживаемость барьерной системы для стерилизации и/или упаковочной системы и ее компонентов обычно поддерживается изготовителем медицинской упаковки, в первую очередь как помощь в определении основной причины всех несоответствий.
А.3.3 Упаковочные материалы должны быть нетоксичными. Руководство по оценке биосовместимости см. в ИСО 10993-1 и ASTM F2475.
Хотя регламент по медицинской упаковке не требуется, обычно используют регламент по упаковке пищевых продуктов как отправную точку при оценивании токсикологических свойств упаковочных материалов, например FDA Code 21 CFR 170-189, BFR 36 XXXVI и регламент Европейской комиссии (the European Commission Regulation) N 10/2011 по пластмассам и изделиям, предназначенным для контакта с пищевыми продуктами. Испытание на биосовместимость последовательно осуществляется в зависимости от конкретной задачи.
Дополнительный вопрос безопасности, который может возникнуть в этой связи, - это возможность выделения веществ из упаковочных материалов с течением времени, которые могут загрязнить медицинское изделие или окружающую среду. Испытания на выделяющиеся упаковкой вещества см. в ASTM D4754.
А.4 Руководство по барьерам
А.4.1 Все стерилизуемые медицинские упаковочные материалы для барьерных систем для стерилизации должны обеспечить эффективный микробный барьер (см. ИСО 11607-1:2006, пункт 5.2). Для непористых материалов это требование удовлетворяется демонстрацией воздухонепроницаемости материала, как описано в ИСО 11607-1:2006, приложение С. В пористых упаковочных материалах микробный барьер можно оценить, используя методы испытания, приведенные в ИСО 11607-1:2006, приложение В.
А.4.2 В дополнение к защите от микробов барьерная система для стерилизации может потребовать защиты от пропускания газов или света. Пропускание газа рассматривают отдельно от пористости материала и относят к гораздо более медленной миграции газовых молекул через твердый материал. Медицинские изделия, которые необходимо хранить, или которые чувствительны к влаге, или на которые воздействует кислород или другие газы, потребуют упаковочных материалов, создающих специальный барьер для рассматриваемого газа или пара. Пропускание водяного пара рассматривается в ASTM F372 и ASTM F1249, а проницаемость для кислорода можно оценить по ASTM D3985.
А.4.3 Измерение пропускания света можно выполнить с помощью спектроскопа, заранее зная длину волны интересующего света. Изготовители медицинских упаковочных материалов могут предоставить информацию, касающуюся барьерных свойств материалов, а в ходе валидации, проведенной изготовителем барьерной системы для стерилизации и/или упаковочной системы, будет оценено, насколько рассматриваемый материал удовлетворяет требованиям, касающимся конкретного медицинского изделия.
А.4.4 Контаминация может произойти из воздуха и из воды. Эффективность влажного бактериального барьера определяется максимальной водонепроницаемостью упаковочного материала.
А.5 Видимость и внешний вид медицинского изделия Существует несколько стандартных методов, которые можно использовать для сравнения упаковочных материалов друг с другом или измерения способности материала выполнить задачи в отношении видимости и внешнего вида изделия. Матовость, которая описывает рассеяние света по мере его прохождения через материал, можно измерить, используя руководство из ASTM D1003. Блеск, который является отражающей способностью или глянцем поверхности подложки, можно определить по ASTM D2457. Непрозрачность является способностью материала останавливать пропускание света, дополнительную информацию по которой можно найти в ASTM D589.
А.6 Физические свойства материалов А.6.1 Ряд физических свойств, которые можно рассмотреть, перечислены в А.6.2-А.6.11. В тексте приводятся примеры стандартных методов испытания, другие методы приведены в ИСО 11607-1:2006, таблица В.1.
В дополнение к выдерживанию процесса стерилизации барьерная система для стерилизации и/или упаковочная система для медицинских изделий должны также защищать стерильность и эффективность до того момента, когда это медицинское изделие потребуется. Форма и масса медицинского изделия, тип защитной упаковки (если она применяется) и системы транспортирования и хранения также будут играть свою роль в критической оценке этого фактора барьерной системы для стерилизации и/или упаковочной системы. Хотя единственным окончательным средством установления пригодности является фактическое использование медицинского изделия, ряд стандартных физических свойств обеспечивают средство оценки потенциальных материалов для использования в данном приложении. Почти ни одно из этих свойств не может идентично отразить способ, которым конкретное медицинское изделие создаст проблемы барьерной системе для стерилизации и/или упаковочной системе. Изготовители упаковочных материалов предоставляют имеющиеся значения для некоторых из этих свойств, они служат инструментом сортировки и обычно предоставляются как типовые значения, а не заданные значения, там где налагаются строгие допуски.
А.6.2 Сопротивление проколу: Сопротивление материала проколу может оказаться важным качеством для рассмотрения, если медицинское изделие имеет острые края или выступы, которые могут прорвать упаковочный материал, нарушив целостность. Руководство представлено в ASTM D1709, ASTM D3420 и ASTM F1306.
А.6.3 Сопротивление истиранию: Сопротивление истиранию - это способность поверхности выдерживать воздействия повторяющегося трения, царапания и разрывания. Это происходит между:
- медицинским изделием и барьерной системой для стерилизации,
- двумя барьерными системами для стерилизации или
- барьерной системой для стерилизации и защитной упаковкой в ходе распределения. Поскольку не существует на настоящий момент испытаний, прогнозирующих подобные эффекты, эксплуатационные испытания барьерной системы для стерилизации и/или упаковочной системы обычно требуются с реальным медицинским изделием.
А.6.4 Сопротивление разрыву: Способность материала сопротивляться разрыву и продолжать распространять начальный разрыв может оказаться важным качеством при вскрытии барьерной системы для стерилизации. Например, материалы для барьерной системы для стерилизации, предусматривающей вскрытие отслаиванием поверхности, должны быть устойчивы к разрыву на участке отслаиваемой поверхности, тогда как материалы для барьерной системы для стерилизации, разрываемой при вскрытии, должны легко распространять разрыв. Методы оценки сопротивления разрыву описаны в ASTM D1922 и ASTM D1938.
А.6.5 Устойчивость к изгибу: Способность материала выдерживать повреждение при многократном изгибании или складывании описывают как устойчивость к изгибу. Форма медицинского изделия, тип используемой защитной упаковки и система транспортирования будут определять важность этого качества. Руководство по испытаниям устойчивости к изгибу приведено в ASTM F392.
А.6.6 Толщина: Обычно прочность конкретного материала увеличивается при увеличении его толщины. В то же время, поскольку при увеличении толщины одновременно увеличивается жесткость, можно достичь состояния, когда увеличение толщины приведет к возникновению хрупкости материала, который будет более подвержен растрескиванию при изгибе (устойчивость к изгибу уменьшается). Методы определения толщины материала описаны в ИСО 534 и ASTM F2251.
А.6.7 Прочность при растяжении: Прочность при растяжении материала - это максимальная растягивающая нагрузка, которая требуется для разрыва или разрушения материала. Ее часто называют пределом прочности при растяжении и выражают как силу на единицу площади. Хотя предел прочности при растяжении остается постоянной величиной, увеличение толщины конкретного материала увеличит силу, требующуюся для его разрыва. Поскольку измерение прочности при растяжении производят в точке выше предела упругости или предела текучести (величина нагрузки, требующейся для постоянной деформации материала), полезность в прогнозировании прочности ограничена. Фактически прочность при растяжении обратно пропорциональна продолжительности срока службы. Руководство по определению предела прочности при растяжении приведено в ИСО 1924-2 и ASTM D882.
А.6.8 Удлинение: Разность длин, выраженная в процентах от первоначальной длины, полученная при воздействии на материал растягивающей нагрузки. Обычно сообщают удлинение при разрыве. Поскольку удлинение при разрыве выходит за предел упругости или предел текучести (величина нагрузки, требующейся для постоянной деформации материала), его использование при прогнозировании прочности ограничено. Руководство по определению удлинения приведено в ASTM D882.
А.6.9 Основная масса: Основная масса материала - это его масса на единицу площади. Методы определения основной массы описаны в ASTM D4321 и ASTM D3776.
А.6.10 Прочность сцепления: Прочность сцепления - это величина усилия, необходимого для разделения слоев материала. Руководство по определению прочности сцепления приведено в ASTM F904.
А.6.11 Прочность во влажном состоянии: Прочность во влажном состоянии важно учитывать, когда упаковку стерилизуют во влажных условиях, например влажным паром или ЕО.
А.7 Целостность барьерной системы для стерилизации А.7.1 Целостность барьерной системы для стерилизации является существенным элементом для медицинского изделия, которое поставляется в стерильном состоянии. Барьерная система для стерилизации обеспечивает уверенность, что медицинское изделие остается в стерильном состоянии до места использования и облегчает асептическое извлечение этого медицинского изделия. Потеря стерильности считается явлением, связанным с физическим нарушением барьерной системы для стерилизации. Частое воздействие избыточных и изменчивых температуры и давления во время хранения и транспортирования или увлажнения упаковки также считаются событиями. Сложно определить и увеличить вероятность контаминации. Следовательно, важно обеспечить создание барьерной системой для стерилизации и/или упаковочной системой соответствующего уровня защиты медицинского изделия, чтобы контроль барьерной системы для стерилизации и/или упаковочной системы, включающей барьерную систему для стерилизации, мог надежно служить мерой поддержания стерильности. Методы испытаний, связанные с целостностью упаковки, включают исследование щупом физических нарушений микробного барьера в результате разрушения клеевого соединения упаковки (барьерной системы для стерилизации) или разрушения самого материала.
А.7.2 Визуальный контроль: Используя ASTM F1886, можно с большой вероятностью обнаружить дефекты в клеевом соединении упаковки (барьерной системе для стерилизации) в форме каналов. Ввиду ряда ограничений для материалов и недостаточности для определенного выявления тонких проколов и мелких разрывов в материалах барьерной системы для стерилизации, визуальный контроль тем не менее является ценным средством мониторинга целостности клеевого соединения. Другими инструментами, которыми можно пользоваться, являются поляризованный свет и невидимый свет. Их обычно не применяют как отдельные методы оценки барьерных систем для стерилизации и/или упаковочных систем в начале, но зачастую они служат как внутрипроизводственная проверка во время серийного производства барьерных систем для стерилизации и/или упаковочных систем.
А.7.3 Проникание красителя: ASTM F1929 включает описание впитывания раствора красителя через канальный дефект. Это традиционный тест для валидации клеевого соединения, если качество клеевого соединения не скоррелировано в ходе визуального контроля. Это испытание наиболее сложно выполнить на целлюлозных материалах.
Результаты испытания красителем могут зависеть от испытуемого материала, опыта и подготовки оператора. В связи с этим необходимо также осторожно интерпретировать результаты. Важно, чтобы испытания проводились операторами, аттестованными как компетентные для проведения таких испытаний. Когда интерпретация результатов испытаний понятна, это дает надежное и чувствительное средство обнаружения каналов, отверстий и т.д.
А.7.4 Испытание на образование пузырьков: ASTM D3078 и ATSM F2096 описывают погружение упаковки (барьерной системы для стерилизации) в жидкость и приложение дифференциала давления. Выделение газа может указывать на наличие утечки. Наилучшим образом подходит для крупных утечек, обычно применяется к упакованным медицинским изделиям после воздействия условий реальной или имитированной отгрузки для оценивания целостности упаковки (барьерной системы для стерилизации).
А.7.5
Другие
методы подтверждения целостности:
Альтернативные приемы включают применение
А.7.6 Провокационные испытания всей упаковки (барьерной системы для стерилизации) на эффективность микробного барьера: Стерильную барьерную систему помещают в камеру и подвергают воздействию аэрозоля с известной концентрацией известного микроорганизма. Затем систему обеззараживают снаружи, открывают асептическим способом и выполняют проверку стерильности медицинского изделия. Это испытание является альтернативой определению физической целостности, хотя эти методы не особо надежны и технически сложны в исполнении. В отсутствие универсальных общепринятых методов эти методы могут подойти для оценки целостности извилистого канала закрытия барьерной системы для стерилизации, если прошли надлежащую валидацию (см. ИСО 11607-1:2006, приложение В).
А.8 Прочность клеевого соединения и сопротивление продавливанию А.8.1 Прочность клеевого соединения: Первичным средством характеризации прочности клеевого соединения упаковки (барьерной системы для стерилизации) является измерение усилия, необходимого для разделения двух компонентов упаковки. Такое разделение может быть частью конструкции барьерной системы для стерилизации и/или упаковочной системы, чтобы облегчить асептическое извлечение содержимого, или может представлять усилие, которое необходимо приложить для разрыва неразъемного (или "сварного") соединения. В любом случае измерения прочности клеевого соединения упаковки (барьерной системы для стерилизации) являются ключевыми индикаторами процесса формирования упаковки.
Прочность соединений со съемным слоем предварительно сформированных барьерных систем для стерилизации является функцией материалов и производственного процесса поставщика. Предполагаемый диапазон значений прочности клеевого соединения наилучшим образом устанавливается изготовителем. Это также справедливо для поставщиков материалов барьерных систем для стерилизации.
А.8.2 Кроме того, в большинстве случаев прочность клеевого соединения служит индикатором контроля процесса формирования клеевого соединения и дает уверенность в том, что упаковка (барьерная система для стерилизации) представляет конструкционно прочную емкость для медицинского изделия. Склеиваемость оцениваемых комбинаций материалов проверяют в лаборатории, используя диапазон условий, установленный для демонстрации граничных значений прочности и качества клеевого соединения. Клеевые соединения испытывают на отслоение при растяжении и анализируют, чтобы определить соответствие полученных результатов желательной прочности на отслаивание для барьерной системы для стерилизации и/или упаковочной системы. Этот процесс обычно используют как инструмент скрининга для выбора комбинаций материалов, он также может использоваться для оценивания прочности клеевого соединения до и после стерилизации. Согласно этому, измерения прочности клеевого соединения можно использовать для мониторинга производства, обеспечения контроля процесса, постольку данные прочности клеевого соединения пригодны для мониторинга процесса.
А.8.3 ASTM F88 является определяющим методом для характеризации прочности клеевого соединения. Разрывная машина растягивает концы точно вырезанного участка клеевого соединения при контролируемой скорости раздвижения захватов, измерении расстояния, на которое они разошлись, и растягивающей нагрузки во время испытания. Обычно клеевые соединения испытывают в нескольких точках по периметру упаковки. ASTM F88 представляет данные о влиянии различий в приемах. Руководство по характеристикам прочности клеевого соединения также приведено в ЕН 868-5.
А.8.4 Сопротивление продавливанию: Средства, с помощью которых испытывают всю упаковку целиком (барьерную систему для стерилизации) на продавливание, включают создание давления внутри упаковки и отслеживание влияния давления на клеевые соединения упаковки. Разделение клеевого соединения (ползучесть), время до разрушения упаковки (разрушение при ползучести) и предел прочности при продавливании - это измерения, выполняемые по методам ASTM F1140 (незакрепленный образец) и ASTM F2054 (закрепленный образец). Хотя испытание на продавливание охватывает всю упаковку (барьерную систему для стерилизации) за один раз, невозможно приложить равномерное усилие ко всем частям упаковки, и это обязательно приведет к большей изменчивости наблюдаемых результатов, чем испытание на отслаивание. Испытание на продавливание обычно используют для внутрипроизводственного контроля. Если оно используется для такого контроля, то во время валидации следует выполнить сопутствующие испытания на растяжение и продавливание.
А.9 Руководство по обработке материалов А.9.1 Большинство технических требований к барьерной системе для стерилизации и/или упаковочной системе и характеристики процесса определяют с помощью измерения размеров. Обычные измерения размеров, связанные с подбором и функциями медицинского изделия, - это полная длина и полная ширина, внутренняя длина и ширина и ширина клеевого соединения. Другие размеры определяют на основе индивидуальной задачи и требований к характеристикам процесса (см. руководство по измерению линейных размеров в ASTM F2203).
А.9.2 Трение может повлиять на обработку упаковочных материалов при движении по металлическим поверхностям, другим подложкам или друг об друга. Например, в операциях укладки и автопогрузки материалы могут подаваться неправильно за счет высокого уровня трения. Категоризация статических и кинетических коэффициентов трения материалов может способствовать надежности обработки барьерной системы для стерилизации и/или упаковочной системы. Дополнительную информацию см. в ASTM D1894.
А.9.3 Формирование барьерной системы для стерилизации и сохранение стерильности зависят от способности к герметизации. Упаковочные материалы можно склеивать при различных условиях. Поэтому характеризация склеиваемости упаковочного материала может включать следующее: размер склеиваемого промежутка, прочность клеевого соединения, наглядное указание места нахождения соединения (если открывается отслаиванием) и способность к обработке чувствительных к температуре материалов. Обычной практикой является оценивание клеевого соединения, выполненного на лабораторном оборудовании, и в зависимости от типа оборудования, типа и места расположения термопар, массы аппарата для склеивания и других факторов условия склеивания могут меняться от аппарата к аппарату (см. ASTM F2029).
А.9.4 Масса слоя клея на покрытой клеем поверхности может повлиять на склеиваемость, прочность клеевого соединения и перенос. В зависимости от клея и склеиваемой поверхности масса слоя клея может повлиять на когезионный и адгезионный тип отказа клеевого соединения при отслаивании, что влияет на стабильность прочности клеевого соединения и перенос клеевого покрытия с поверхности на поверхность. Для согласованных результатов склеивания и отслаивания масса слоя клея должна оставаться в установленном интервале значений (см. ASTM F2217).
А.10 Руководство по печати А.10.1 Новые упаковочные материалы, на которые предполагается наносить маркировку печатью, могут потребовать оценки пригодности для печатания. Пригодность для печатания материала связана с его смачиваемостью или поверхностным натяжением. Для измерения поверхностного натяжения можно использовать измерители контактного угла смачивания или тестовые маркеры, чтобы определить уровень обработки поверхности и/или пригодную для печати сторону упаковочного материала. Некоторые обработанные поверхности могут деградировать, что влияет на пригодность для печати со временем.
А.10.2 Краска плохого качества или плохое закрепление/адгезия к материалу может повлиять на внешний вид и удобочитаемость печати или на функциональность покрытий на упаковочных материалах. Поскольку приемлемость степени закрепления является специфичной для каждого применения, необходимо согласовать критерии приемлемости между пользователем и изготовителем упаковочного материала (см. ASTM F2252).
a) Печать, предназначенная для передачи информации, не должна иметь пропусков, мазков, пятен, подтеков или смещения, что ведет к ее неправильности и нечитабельности (см. ИСО 11607-1:2006, пункт 5.4). Печать в зоне склеивания может повлиять на склеиваемость материала, а также на процесс склеивания, может повлиять на типографскую краску и/или разборчивость печати. Другой проблемой может стать совместимость с выбранным процессом стерилизации, где температура и/или химическая стойкость могут повлиять на печать.
b) Истирание упаковочного материала с напечатанной маркировкой в среде распределения может изменить внешний вид графики барьерной системы для стерилизации и/или упаковочной системы из-за царапин, стирания краски, сдвига или превращения маркировки в нечитаемую. В лабораторных условиях сравнение сопротивления истиранию поверхности маркированных материалов с установленными стандартами может апроксимировать* воздействия при отправке и обращении. Дополнительное руководство см. в ASTM D5264.
c) Поверхность с печатью барьерной системы для стерилизации и/или упаковочной системы может подвергнуться воздействию химических веществ во время жизненного цикла. Химические вещества могут разложить, размягчить, смазать и стереть печать, что повлияет на внешний вид и разборчивость. Относительную стойкость к воздействию известных или ожидаемых химических веществ необходимо оценить. Дополнительное руководство см. в ASTM F2250.
А.11 Чистота и наличие твердых частиц А.11.1 Посторонним материалом, который находится на поверхности барьерной системы для стерилизации и/или упаковочной системы и который можно очистить щеткой или стереть, считаются отдельные твердые частицы. Их должно быть минимальное количество. Уровень неизбежно присутствующих частиц будет зависеть от выбранного упаковочного материала. Размер частиц часто оценивают по карте оценки сора TAPPI Dirt Estimation Chart.
А.11.2 Необходимо свести к минимуму количество постороннего материала, который располагается между слоями материала или на пленке, нетканом материале или бумаге. Гели, частички смолы с молекулярной массой выше среднего, по виду напоминающие мелкую твердую стеклянную крошку, не являются посторонним материалом и присущи множеству материалов на основе полимеров. Частицы углерода являются обуглившимися частичками основного материала, обработанного при высокой температуре. Гели и частицы углерода рассматривают отдельно от вкрапленных частиц постороннего материала. См., например, IEST-STD-CC1246D, который предлагает основу и единый метод установления требований к уровням чистоты продукта и программы контроля загрязнения.
А.12 Ускоренное старение и проблемы окружающей среды А.12.1 Следующие определения включены в ASTM F17:
a) ускоренное старение - техника имитации влияния времени на упаковку путем воздействия на систему продукция/упаковка повышенными температурами в регулируемых условиях окружающей среды, представительных для условий хранения. Эквивалентное время обычно оценивают по деградации упаковочных материалов по кинетике, описанной функцией Аррениуса, зависимости скорости химической реакции от температуры. Более подробно см. в ASTM F1980;
b) экологические проблемы - процесс воздействия на упаковку максимальной и минимальной температурой и влажностью и/или другими предельными условиями окружающей среды с целью определения чувствительности упаковки к возникающим напряжениям. В противовес ускоренному старению экологические проблемы часто включают условия или переходы либо то и другое вместе температуры и влажности, равных или превышающих параметры, которые возникают в жизненном цикле упаковки. Дополнительное руководство см. в ASTM F2825.
Для примеров расчетов продолжительности ускоренного старения и выбора температуры старения в реальном времени см. ASTM F1980.
А.12.2 При ускоренном старении уровни температуры и влажности выбирают так, чтобы материалы не достигали температур физического перехода. При решении экологических задач целью является оценка эффективности барьерной системы для стерилизации и/или упаковочной системы в экстремальных условиях, возможных на жизненном цикле упаковки, либо напряжение материала вблизи или после критической точки.
Такое установление границ опирается на тот факт, что различные материалы имеют различную чувствительность к температуре и влаге и выводы относительно пригодности данного материала в качестве компонента барьерной системы для стерилизации и/или упаковочной системы могут оказаться недостоверными. Например, бумага является особо чувствительной к относительной влажности. Избыточная сушка отрицательно отражается на прочностных свойствах, а избыточная влажность может привести к образованию плесени. Некоторые слоистые материалы могут отказать в экстремальных условиях, хотя в реальном времени и при контролируемом старении они редко или вообще не демонстрируют такой результат.
А.12.3 Производство медицинских изделий постоянно развивается, поэтому требование старения в реальном времени перед выпуском на рынок и продажей зачастую непрактично. Применение для испытания срока годности барьерной системы для стерилизации и/или упаковочной системы ускоренного старения обычно принимается как обоснованное для введения новых медицинских изделий при условии, что старение в реальном времени на месте подтвердит результаты испытания с ускоренным старением. Обычно осуществляют серию испытаний для проверки целостности упаковки, особенностей вскрытия упаковки (если имеются) и общих свойств самих упаковочных материалов. Получение значений свойств до и после стерилизации важно для определения влияния процесса стерилизации до начала процесса старения на материалы и клеевые соединения барьерной системы для стерилизации. Изучение старения можно производить на пустых барьерных системах для стерилизации (см. ИСО 11607-1:2006, пункт 6.3), подвергнув их максимальному числу предполагаемых циклов стерилизации. Если образец для старения не включает содержимого, документально подтверждают обоснование, поддерживающее конфигурацию испытуемого образца. Другие подходы включают изучение отгрузки, выполненной в момент, принятый за начало отсчета времени. Испытание свойств материала тогда следует как мера влияния времени, смоделированного ускоренным старением.
Использование
уравнения Аррениуса обычно признается
как подход для определения влияния
температуры на скорость гомогенной
реакции первого порядка. Упрощенный
расчет
Температуру выбирают с осторожностью, так, чтобы не повредить материалы, применив условия, которые не ожидаются в реальной жизни или выходят за рамки рекомендованного диапазона применения рассматриваемого материала. См. в ASTM F1980 руководство по влиянию влажности в процессе ускоренного старения.
При выборе температур для проведения ускоренного старения следует соблюдать осторожность, чтобы не привести к переходным состояниям материалы, не повредить барьерную систему для стерилизации и/или упаковочную систему и не ввести нелинейных изменений, таких как кристалличность, образование свободных радикалов, разложение перекисей.
При рассмотрении роли влажности в ускоренном старении важно осознавать, что такое относительная влажность, - это количество воды, взвешенной в воздухе, относительно количества воды, требуемого для насыщения воздуха при этой температуре. В связи с этим существует опасность, что поддержание такого же процента относительной влажности, как в окружающей среде при изучении ускоренного старения, обязательно приведет к более высокому воздействию влажности, чем обычно при старении в реальном времени. Подробное обсуждение этой темы см. в [107].
А.12.4 Другой аспект испытаний барьерной системы для стерилизации относится к экологическим проблемам или кондиционированию материала при различных температурах и уровнях влажности, чтобы имитировать воздействие различных условий при отправке в места с различным климатом. Можно использовать циклическое применение тепла-холода для имитации сезонных колебаний, которым могут подвергаться упакованные медицинские изделия, в то же время необходимо обратить внимание на скорость изменения.
Уровни температуры и влажности следует выбирать осторожно, на основе понимания распределения продукции и условий ее использования. Описанное выше обсуждение влияния температуры и влажности, с ожиданием линейной зависимости, также связано с экологическими требованиями. Один из подходов для обычно используемой системы распределения можно найти в ASTM F2825.
А.12.5 Изготовитель медицинского изделия принимает окончательное решение в отношении пригодности упаковочного материала и/или системы для обеспечения максимальной эффективности стерилизованного медицинского изделия. Это обсуждение должно служить руководством при выборе условий испытания барьерной системы для стерилизации и/или упаковочной системы или упаковочного материала, так, чтобы можно было сделать экспертное заключение относительно характеристик барьерной системы для стерилизации и/или упаковочной системы с течением времени и отделить испытания срока годности от экологического воздействия температуры и влажности.
Приложение В (справочное)
Вопросы стерилизации. Руководство для производства и медицинских учреждений В.1 Общее представление В.1.1 Полное рассмотрение процесса стерилизации медицинского изделия, подлежащего финишной стерилизации, должно быть включено в проектирование медицинского изделия и барьерной системы для стерилизации и/или упаковочной системы и верификацию для определения совместимости (см. ИСО 11607-1:2006, пункт 5.3). Очень часто метод стерилизации диктует аспекты выбора материалов, конфигурацию барьерной системы для стерилизации и/или упаковочной системы, размер и логистику медицинского изделия.
Некоторые аспекты, которые необходимо учитывать:
a) выбор материала - пористый или непроницаемый;
b) методы стерилизации газом обычно требуют пористых барьерных систем для стерилизации;
c) методы стерилизации радиацией могут использовать и пористые, и непроницаемые барьерные системы для стерилизации. Иногда пористые барьерные системы для стерилизации используют для ослабления запахов, которые могут появиться при облучении;
d) совместимость - способность выдерживать процесс:
- рассматривают характеристики медицинского изделия и барьерной системы для стерилизации и/или упаковочной системы после воздействия выбранного метода стерилизации при крайних значениях переменных процесса или после многократного воздействия. Например, важно понимать, какие физические свойства (функциональные или внешние) могут измениться у данного материала, подвергающегося облучению, и что разные методы стерилизации облучением - электронно-лучевое или гамма-излучение - и/или доза облучения могут иметь разное влияние на материалы;
e) плотность/ориентация:
- рассматривают эффекты затенения других медицинских изделий, находящихся в том же контейнере или в соседних контейнерах (электронно-лучевое или гамма-излучение);
f) специальные ограничения на переноску/конвейер:
- рассматривают ограничения процесса стерилизации, т.е. размер емкости для переноски при стерилизации гамма-лучами, зазоры на конвейере для электронно-лучевого излучения, размеры палет для ЕО-стерилизации и т.д.;
g) конфигурация палет:
- рассматривают такую конфигурацию палет, чтобы в стерилизаторе она не требовала глобальных переделок (при договорной стерилизации), учитывают оптимальное использование пространства и эффективность подачи.
В.1.2 Некоторые руководящие указания по факторам для рассмотрения конкретных широко используемых методов промышленной стерилизации перечислены ниже. Наука стерилизационной обработки продолжает развиваться. Необходимо внимательно изучать новые технологии, чтобы определить, какие свойства материалов и расчетные характеристики являются критическими для успешной обработки.
В.2 Этиленоксид (ЕО) В.2.1 Краткое описание процесса: стерилизация алкализирующим газом в присутствии тепла и влаги.
В.2.2 Аспекты медицинского изделия/барьерной системы для стерилизации:
a)
Медицинское изделие, барьерная система
для стерилизации и типографская краска
должны выдерживать повышенную влажность
и температуры (обычно
b) Медицинское изделие должно иметь участки, проницаемые для газа и позволяющие газу контактировать со всеми участками медицинского изделия.
c) Барьерная система для стерилизации должна иметь пористые участки, которые позволяют входить и выходить газу. Транспорт газа через проницаемые участки должен происходить со скоростью, достаточной для поддержания целостности барьерной системы для стерилизации при воздействии вакуума и/или в процессе наполнения. Необходимо следить за тем, чтобы конфигурация индивидуальных барьерных систем для стерилизации, содержащихся в барьерной системе и/или упаковочной системе, не препятствовала их проницаемости. Необходимо избегать тесного контакта проницаемого материала с непроницаемым, поскольку это может помешать проникновению газа.
В.2.3 Аспекты процесса:
а) Расчет времени: процесс может занять несколько дней на предварительное кондиционирование, стерилизацию и аэрацию. Время ожидания необходимо для выпуска с применением биологических индикаторов, если не используется выпуск по параметрам.
b) Эффективность также зависит от времени производства на достижение полной нагрузки, которая часто составляет от нескольких до большого числа палет.
c) Объем нагрузки: основан на размере камеры и аспектов валидации стерилизации.
d) Цикл стерилизации можно адаптировать к требованиям к медицинскому изделию и микробиологическим требованиям.
e) Остаточные количества ЕО дегазируют до достижения безопасных пределов как часть установочных параметров циклов процесса стерилизации, а медицинское изделие требует испытания на остаток продуктов стерилизации (см. ИСО 10993-7).
В.2.4 Дополнительную информацию по ЕО-стерилизации см.:
- ИСО 11135-1;
- ИСО 10993-7;
- ИСО/TS 11135-2;
- AAMI TIR15;
- AAMI TIR16;
- AAMI TIR19;
- AAMI TIR20;
- AAMI TIR28.
В.3 Гамма-излучение В.3.1 Краткое описание процесса: упакованное медицинское изделие подвергается ионизирующему излучению в форме гамма-фотонов большой энергии от радиоактивного источника, например кобальта-60, которое разрушает молекулярную структуру микробов и делает невозможным воспроизводство.
В.3.2 Аспекты медицинского изделия/барьерной системы для стерилизации и/или упаковочной системы:
a) Медицинское изделие, барьерная система для стерилизации и/или упаковочная система и типографская краска требуют использования материалов, которые выдерживают ионизирующее излучение. Образование поперечных сшивок и обрыв цепочек может привести к функциональным физическим изменениям и изменениям внешнего вида, а также к процессу развития на некоторых материалах. Может потребоваться замена материалов на радиационно-стойкие.
b) Необходимо учитывать, что при использовании этого метода могут возникнуть высокие температуры.
c) Плотность укладки в упаковку (коробку) является важным фактором и подлежит контролю, чтобы оставалась постоянной в процессе поддержания дозиметрического выпуска.
d) Этот метод следует рассматривать, если медицинское изделие закрыто на участках, которые не могут быть стерилизованы газом, или когда требуется непористая барьерная система для стерилизации и/или упаковочная система.
e) Размер коробки следует оптимизировать для совмещения с размером носителя аппарата для облучения.
В.3.3 Аспекты процесса:
a) Расчет времени: процесс занимает относительно короткий срок, однако могут возникнуть периоды ожидания, поскольку медицинские изделия схожей плотности следует стерилизовать вместе. Поскольку процесс использует дозиметрический выпуск, ожидания после стерилизации не требуется.
b) Размер загрузки основан на размере носителя, используемого для излучателя, и изучении топографирования дозы.
В.3.4 Дополнительную информацию по радиационной стерилизации см.:
- ИСО 11137-1;
- ИСО 11137-2;
- ИСО 11137-3;
- AAMI TIR17;
- AAMI TIR29;
- AAMI TIR33;
- AAMI TIR35.
В.4 Электронно-лучевая стерилизация (E-Beam) В.4.1 Краткое описание процесса: основанная на ускорителе система стерилизует медицинские изделия, направляя концентрированный пучок электронов на барьерную систему для стерилизации и/или упаковочные системы, содержащие готовое медицинское изделие.
В.4.2 Аспекты медицинского изделия/барьерной системы для стерилизации и/или упаковочной системы:
a) Материалы медицинского изделия, барьерной системы для стерилизации и типографскую краску выбирают внимательно, так, чтобы они выдерживали Е-облучение. Влияние на материалы может оказаться менее сильным, чем при гамма-излучении.
b) Плотность укладки в упаковку (коробку) является важным фактором и подлежит контролю, чтобы оставалась постоянной в процессе поддержания дозиметрического выпуска.
c) Этот метод следует рассматривать, если медицинское изделие закрыто на участках, которые не могут быть стерилизованы газом.
В.4.3 Аспекты процесса:
a) Расчет времени: барьерные системы для стерилизации пропускают через процесс стерилизации на конвейере, иногда требуется два прохода. Поскольку процесс использует дозиметрический выпуск, ожидания после стерилизации не требуется.
b) Ориентация медицинского изделия/барьерной системы для стерилизации и/или упаковочной системы подлежит контролю, так, чтобы на все части медицинского изделия действовал электронный пучок, т.е. необходимо избегать проблемы, называемой "затенение".
c) Размер загрузки: ограничен требованиями к плотности и критериями оборудование/конвейер.
d) При встраивании в технологический поток такой метод стерилизации может быть очень эффективным.
В.4.4 Дополнительную информацию по электронно-лучевой стерилизации см.:
a) ИСО/ASTM 51649;
b) стандарты на гамма-излучение (см. В.3.4).
В.5 Рентгеновская лучевая стерилизация В.5.1 Краткое описание процесса: упакованное медицинское изделие подвергают воздействию так называемого тормозного облучения рентгеновскими лучами от ускоренных ионизированных частиц. Этот процесс изменяет химические и молекулярные связи, вызывая нарушение воспроизводства у микроорганизмов.
В.5.2 Аспекты медицинского изделия/барьерной системы для стерилизации и/или упаковочной системы:
a) Медицинское изделие/барьерная система для стерилизации и/или упаковочная система требует утилизировать материалы, которые могут выдержать ионизирующее излучение. Хотя этот процесс воздействует менее продолжительно и меньшими дозами, поперечные сшивки могут привести к внешним (пожелтение) изменениям и функциональным изменениям физических свойств.
b) Барьерная система для стерилизации и/или упаковочная система не требуют пористой мембраны, поскольку рентгеновские лучи проникают через упаковочные материалы и в структуры медицинского изделия.
c) Цикл оказывает ограниченное напряжение на клеевые соединения барьерной системы для стерилизации, поскольку не включает вакуумные фазы.
d) Плотность конфигурации палет или приспособлений для переноса является важным фактором и подлежит контролю, чтобы оставалась постоянной в процессе поддержания дозиметрического выпуска.
e) Рассматривают систему обращения с материалами устройств для переноса и палет для договорных стерилизаторов, чтобы оптимизировать конструкцию барьерной системы для стерилизации и/или упаковочной системы и уменьшить мертвое пространство в цикле стерилизации.
В.5.3 Аспекты процесса:
a) Эффективность также зависит от барьерной системы для стерилизации и/или упаковочной системы, транспортной тары, конфигурации палет для готового медицинского изделия.
b) Размеры загрузки: на основе ограничений предприятия и аспектов валидации, выведенных из графиков производства и входных данных, рассмотренных при валидации стерилизации.
В.6 Паровая стерилизация (влажным паром) В.6.1 Краткое описание процесса: упакованное медицинское изделие подвергается действию насыщенного водяного пара и повышенных температур. Пар является стерилизующим средством и должен проходить через барьерную систему для стерилизации и/или упаковочную систему до контакта с медицинским изделием.
В.6.2 Аспекты медицинского изделия/барьерной системы для стерилизации и/или упаковочной системы:
a) Медицинское изделие, барьерная система для стерилизации и/или упаковочная система и типографская краска не должны быть чувствительны к водяному пару или конденсату и повышенным температурам.
b) Барьерная система для стерилизации и/или упаковочная система должны иметь пористые участки, которые позволят пару входить и выходить из барьерной системы для стерилизации и/или упаковочной системы. Транспорт пара через проницаемую часть должен осуществляться со скоростью, достаточной для поддержания целостности барьерной системы для стерилизации в процессе вакуумирования и/или наполнения. Необходимо следить, чтобы конфигурация индивидуальных барьерных систем для стерилизации, содержащихся в барьерной системе для стерилизации и/или упаковочной системе, не препятствовали проницаемости. Необходимо избегать тесного контакта проницаемого материала с непроницаемым, поскольку это может помешать проникновению пара.
c) Медицинское изделие должно иметь входы, позволяющие пару достигать устойчивого контакта со всеми частями изделия.
В.6.3 Аспекты процесса:
a) Расчет времени: обычно процесс занимает меньше 2 ч, аэрации не требуется. Если не используется выпуск стерилизованной продукции по параметрам, то стерилизованную продукцию выдерживают до получения удовлетворительных результатов тестов биологических индикаторов.
b) Размер загрузки: ограничен критериями оборудования и валидацией процесса стерилизации для медицинского изделия.
В.6.4 Дополнительную информацию по паровой стерилизации см.:
- ИСО 17665-1;
- ИСО/TS 17665-2.
В.7 Стерилизация с использованием влажного тепла и непористой упаковки В.7.1 Краткое описание процесса: пар или горячая вода под давлением используется в качестве среды для нагревания упакованного медицинского изделия.
В.7.2 Аспекты медицинского изделия/барьерной системы для стерилизации и/или упаковочной системы:
a) Медицинское изделие/барьерная система для стерилизации и/или упаковочная система и типографская краска не должны быть чувствительны к влажному насыщенному пару и повышенным температурам.
b) Влага должна присутствовать внутри барьерной системы для стерилизации, чтобы создавать водяной пар и давление, которые будут стерилизовать медицинское изделие.
c) Медицинское изделие должно иметь входы, позволяющие пару и/или воде под напором достигать устойчивого контакта со всеми частями изделия.
В.7.3 Аспекты процесса:
a) Расчет времени: процесс занимает несколько часов, аэрации не требуется. Если не используется выпуск стерилизованной продукции по параметрам, то выпуск продукции задерживается до получения удовлетворительных результатов тестов биологических индикаторов.
b) Размер загрузки: ограничен критериями оборудования и валидацией процесса стерилизации для медицинского изделия.
c) Обычно требуется контроль избыточного давления для барьерных систем для стерилизации с отслаивающейся поверхностью.
В.7.4 Дополнительную информацию по паровой стерилизации см. в ИСО 17665-1.
В.8 Сухой жар В.8.1 Краткое описание процесса: упакованное медицинское изделие подвергают воздействию высоких температур в течение продолжительного периода времени.
В.8.2 Аспекты медицинского изделия/барьерной системы для стерилизации и/или упаковочной системы:
Медицинское изделие/барьерная система для стерилизации и/или упаковочная система и типографская краска должны выдерживать высокие температуры, обычно 160°С и выше, в течение нескольких часов или в течение более продолжительного времени при менее высоких температурах.
В.8.3 Аспекты процесса:
a) Расчет времени: процесс занимает несколько часов, аэрации не требуется. Если не используется выпуск стерилизованной продукции по параметрам, то выпуск продукции выдерживают до получения удовлетворительных результатов тестов биологических индикаторов.
b) Размер загрузки: ограничен критериями оборудования и валидацией процесса стерилизации для медицинского изделия.
В.8.4 Дополнительную информацию по стерилизации сухим жаром см. в ИСО 20857.
В.9 Стерилизация пероксидами В.9.1 Существует два типа такой стерилизации:
a) плазменная стерилизация, также известна как низкотемпературная плазменная стерилизация перекисью водорода (LTHPGP);
b) стерилизация перекисью водорода при испарении подобна, но не идентична плазменной стерилизации. Оба этих метода используют перекись водорода, которую испаряют, но плазменная стерилизация включает этап образования плазмы.
В.9.2 Краткое описание процесса: упакованное медицинское изделие помещают в камеру при низких температурах и подвергают воздействию газообразной перекисью водорода (испаренной) или плазменному воздействию.
В.9.3 Аспекты медицинского изделия/барьерной системы для стерилизации и/или упаковочной системы:
a) Медицинское изделие/барьерная система для стерилизации и/или упаковочная система и типографская краска должны выдерживать температуры до 55°С при относительной влажности до 80% RH на продолжении цикла валидации.
b) Если используется плазма, медицинское изделие/барьерная система для стерилизации и/или упаковочная система и типографская краска должны быть совместимы с плазмой и процессом образования плазмы.
c) Медицинское изделие/барьерная система для стерилизации и/или упаковочная система и типографская краска не должны быть чувствительны к глубокому вакууму или перекиси водорода.
d) Медицинское изделие должно выдерживать степени изменения давления, обеспечиваемые оборудованием.
e) Медицинское изделие должно иметь каналы для проникновения газа и достижения его полного контакта со всеми частями медицинского изделия.
f) Барьерная система для стерилизации и/или упаковочная система должны иметь пористые участки, позволяющие газу входить внутрь и выходить из систем. Транспорт газа через проницаемую часть должен осуществляться со скоростью, достаточной для поддержания целостности барьерной системы для стерилизации в процессе вакуумирования и/или наполнения.
g) В этом процессе нельзя использовать целлюлозные материалы.
В.9.4 Аспекты процесса:
a) Расчет времени: обычно процесс занимает несколько часов, аэрации не требуется. Некоторые загрузки могут потребовать аэрации или дополнительного цикла промывки под вакуумом/давлением, чтобы избежать попадания газа в рабочую зону. Если не используется выпуск стерилизованной продукции по параметрам, то выпуск продукции задерживается до получения удовлетворительных результатов тестов биологических индикаторов.
b) Размер загрузки: ограничен критериями оборудования и валидацией процесса стерилизации для медицинского изделия.
c) Выброс из камеры следует направлять через устройство контроля загрязнения для разрушения пероксида, прежде чем он попадет в рабочую зону или окружающую атмосферу.
В.10 Озон В.10.1 Краткое описание процесса: стерилизация озоном - это низкотемпературный процесс газовой стерилизации. Упакованное медицинское изделие подвергают повышенной влажности и обработке озоном. Подавление микроорганизмов достигается за счет механизмов окисления.
В.10.2 Аспекты медицинского изделия/барьерной системы для стерилизации и/или упаковочной системы:
a) Медицинское изделие/барьерная система для стерилизации и/или упаковочная система и типографская краска должны выдерживать повышенную влажность, глубокий циклический вакуум и обработку озоном. Необходимо консультироваться с изготовителями медицинского оборудования и стерилизаторов для определения совместимости медицинского изделия с озоном.
b) Барьерная система для стерилизации и/или упаковочная система должны иметь пористые участки, позволяющие газу входить внутрь и выходить из систем. Транспорт газа через проницаемую часть должен осуществляться со скоростью, достаточной для поддержания целостности барьерной системы для стерилизации в процессе вакуумирования и/или наполнения.
c) Медицинское изделие должно иметь каналы для проникновения газа и достижения его полного контакта со всеми частями медицинского изделия.
В.10.3 Аспекты процесса:
a) Расчет времени: процесс занимает несколько часов, аэрации не требуется. Для мониторинга процесса следует использовать химические индикаторы и автономные биологические индикаторы (использующие Geobacillus stearothermophilus), одобренные FDA (Управление США по контролю качества пищевых продуктов и медикаментов) для применения с озоновым стерилизатором. Стерилизованный продукт необходимо выдержать до получения удовлетворительных результатов испытаний биологических индикаторов. В настоящее время не существует параметрического выпуска для данного метода стерилизации.
b) Размер загрузки: ограничен критериями оборудования и валидацией процесса стерилизации для медицинского изделия. Стерилизатор следует загружать в соответствии с инструкциями по эксплуатации изготовителя стерилизатора.
В.10.4 Дополнительную информацию по стерилизации озоном см. ANSI/AAMI ST58.
В.11
Диоксид хлора ( В.11.1 Краткое описание процесса: газовая стерилизация диоксидом хлора является низкотемпературным процессом. Этот процесс аналогичен ЕО-стерилизации. Диоксид хлора - окислитель, и подавление жизнедеятельности микроорганизмов достигается за счет окислительных механизмов. Спорицидные свойства такой стерилизации можно сравнить со свойствами испаряющейся перекиси водорода и формальдегида.
В.11.2 Аспекты медицинского изделия/барьерной системы для стерилизации и/или упаковочной системы:
a) С диоксидом хлора совместим нетканый полиолефин, а также различные прозрачные пленки, композитные материалы в виде фольги и жесткие пластики. Можно применять некоторые виды бумаги. Небеленый гофрокартон использовать не рекомендуется.
b) Медицинское изделие/барьерная система для стерилизации и/или упаковочная система и типографская краска должны выдерживать условия окисления и повышенной влажности (обычно от 55 до 70% RH). Концентрация газа (обычно от 5 до 30 мг/л) и влажность будут зависеть от схемы цикла стерилизации.
c) Медицинское изделие должно иметь каналы для проникновения газа и достижения его полного контакта со всеми частями медицинского изделия.
d) Барьерная система для стерилизации и/или упаковочная система должны иметь пористые участки, позволяющие газу входить внутрь и выходить из систем. Транспорт газа через проницаемую часть должен осуществляться со скоростью, достаточной для поддержания целостности барьерной системы для стерилизации в процессе вакуумирования и/или наполнения.
В.11.3 Аспекты процесса:
a) Расчет времени. Этапы процесса обычно включают:
1) предварительное кондиционирование или увлажнение;
2) CD-впуск;
3) экспонирование;
4) CD-выпуск и аэрация медицинского изделия.
Процесс в целом может занять несколько часов (в зависимости от относительной влажности, объема медицинского изделия и размера стерилизационной камеры). Время предварительного кондиционирования аналогично типичным ЕО-процессам, тогда как время аэрации несколько короче. Если для выпуска продукции используют биологические индикаторы, то стерилизованный продукт необходимо выдержать до получения удовлетворительных результатов тестов биологических индикаторов. Параметрический выпуск возможен, поскольку можно осуществлять прямой мониторинг концентрации CD на протяжении процесса стерилизации.
b) Размер загрузки: ограничен критериями оборудования и валидацией процесса стерилизации для медицинского изделия.
c) Эффективность будет также зависеть от времени производства на получение полной загрузки, которая представляет от нескольких палет до большого числа палет.
d) Цикл стерилизации можно некоторым образом адаптировать для соблюдения микробиологических требований и требований к медицинскому изделию.
e) Снижение концентрации диоксида хлора до безопасного уровня входит в процесс стерилизации. Медицинское изделие необходимо испытать на остатки после стерилизации и побочные продукты.
Приложение С (справочное)
Примеры способов обертывания. Руководство для медицинских учреждений С.1 Общие положения Представленные ниже чертежи иллюстрируют несколько методов обертывания медицинских изделий для стерилизации. Эти примеры не предполагают показать единственные способы обертывания, поскольку существуют другие приемлемые методы. Обертывание может производиться последовательно или одномоментно. Можно использовать разные способы для разных слоев. Необходимо ограничить площадь, покрываемую лентой или этикетками, чтобы обеспечить адекватный пористый участок для эффективной стерилизации и сушки. Приемлемость способа обертывания зависит от заворачиваемых медицинских изделий и определяется пользователем.
С.2 Метод пакета
Этапы обертывания показаны на рисунках С.1-С.4.
Рисунок С.1 - Метод пакета, шаги 1-3 Шаг 1: Медицинское изделие (изделия) помещают на середину листа таким образом, чтобы его края образовали прямые углы с диагоналями листа.
Шаг 2: Лист загибают вверх на более широкую сторону изделия(й) и закладывают параллельно продольному краю так, чтобы полностью закрыть стерилизуемое изделие. При этом образуется треугольник (уголок), за который можно открыть обертку асептически.
Шаг 3:
Та же процедура, как в шаге 2, но справа налево.
Рисунок С.2 - Метод пакета, шаги 4-6 Шаг 4: Та же процедура, как в шаге 3, но слева направо.
Шаг 5: Последнюю часть листа загибают над медицинским изделием. Закрываемый угол листа засовывают в пакет, пока не высунется кончик.
Шаг 6:
Лист закрывают подходящим приспособлением с индикатором процесса или без него.
Рисунок С.3 - Метод пакета с одновременным двойным обертыванием
Русунок С.4, лист 1 - Метод пакета с последовательным двойным обертыванием
Рисунок С.4, лист 2 С.3 Параллельное упаковывание/обертывание методом складывания прямоугольника
Шаги для параллельного обертывания показаны на рисунках С.5-С.9.
Рисунок С.5 - Метод упаковывания/складывания прямоугольника, шаги 1-3 Шаг 1: Медицинское изделие (изделия) помещают на середину листа.
Шаг 2: Передней частью листа накрывают медицинское(ие) изделие(я).
Шаг 3:
Край листа закладывают в обратную сторону приблизительно до уровня расположения медицинского(их) изделия(й).
Рисунок С.6 - Параллельное обертывание, шаги 4-7 Шаг 4: Заднюю сторону листа складывают вперед.
Шаг 5: Край листа отгибают наружу так, чтобы лист заканчивался на уровне верхней передней кромки.
Шаги 6, 7 и 8: Обертку складывают с боков и заложенные концы укладывают на изделие(я).
Шаг 9:
Лист закрывают подходящим приспособлением с индикатором процесса или без него.
Рисунок С.7 - Параллельное обертывание, шаги 8 и 9
Рисунок С.8 - Метод складывания прямоугольника, одновременное двойное обертывание
Рисунок С.9 - Метод складывания прямоугольника, последовательное двойное обертывание С.4 Метод Пастера или рулона
Шаги для метода Пастера или рулона показаны на рисунке С.10.
Рисунок С.10 - Метод Пастера или рулона
Приложение D (справочное)
Документация планов валидации. Руководство для медицинских учреждений Примечание - Пользователям форм, предложенных в данном приложении, разрешается делать копии этих форм, при этом за ИСО остаются все другие права, относящиеся к этому документу в целом.
D.1 Общие положения
Контрольные листы, приведенные в приложении D, можно применять для выполнения и документирования валидации процессов упаковывания. Это можно комбинировать с валидацией и ревалидацией процесса стерилизации и документацией. Следующую таблицу можно использовать для организации ряда валидаций.
Таблицу D.1 можно использовать для определения количества валидаций процесса, которые следует выполнить.
Таблица D.1 - Число валидаций процесса
D.2 Контрольный лист плана валидации: процесс термосклеивания предварительно сформированных барьерных систем для стерилизации (PSBS: пакеты, рулоны и т.д.)
з) Этапы аттестации
D.3 Контрольный лист плана валидации: процесс обертывания
в) Описание системы закрытия обертки
г) Описание барьерных систем для стерилизации в сборе (обертывание)
д) Описание процессов стерилизации
е) Описание защитной упаковки, а также проблемы обращения, транспортирования, распределения и хранения
ж) Критерии приемки - определить метод и критерии приемки
з) Этапы аттестации
D.4 Контрольный лист валидации: процесс применения контейнера
в) Описание системы контроля вскрытия, использующейся для демонстрации целостности закрытия
г) Описание контейнера в сборе
д) Описание процессов стерилизации
е) Описание проблем обращения, распределения и хранения
ж) Критерии приемки - определить метод и критерии приемки
з) Этапы аттестации
D.5 Контрольный лист обращения, распределения и хранения
Следующий контрольный лист поможет выбрать барьерную систему для стерилизации.
Приложение Е (справочное)
Документация по аттестации монтажа. Руководство для медицинских учреждений Примечание - Пользователям форм, предложенных в данном приложении, разрешается делать копии этих форм, при этом за ИСО остаются все другие права, относящиеся к этому документу в целом.
Е.1 Контрольный лист аттестации монтажа (IQ): процесс термосклеивания
а) Общие данные
б) Условия установки
в) Документация
г) Характеристики безопасности
Инструкции по эксплуатации общедоступны для верификации этих аспектов. Кроме того, следующие аспекты должен проверять уполномоченный работник
д) Критические параметры
Следующие дополнительные аспекты определяет или проверяет пользователь (требуется частичная верификация)
Следующие дополнительные аспекты подтверждаются верификацией
е) Обучение и рабочая зона
Обучение
Рабочая зона
Проведена ли верификация следующего?
Е.2 Контрольный лист аттестации монтажа (IQ): процесс обертывания
Обычно аттестация IQ выполняется только тогда, когда имеется оборудование, которое необходимо установить. Альтернативно для процесса, который включает только людей и исполнение ими задач, разработка SOP и обучение их может рассматриваться некоторыми учреждениями как IQ. Подготовку конкретных операторов, нанятых для OQ и PQ, следует документировать в отчетах об аттестации.
Обучение
Рабочая зона
Проведена ли верификация следующего?
Е.3 Контрольный лист аттестации монтажа (IQ): процесс с применением контейнера
Обычно аттестация IQ выполняется только тогда, когда имеется оборудование, которое необходимо установить. Альтернативно для процесса, который включает только людей и исполнение ими задач, разработка SOP и обучение их может рассматриваться некоторыми учреждениями как IQ. Подготовку конкретных операторов, нанятых для OQ и PQ, следует документировать в отчетах об аттестации.
Обучение
Рабочая зона
Проведена ли верификация следующего?
Приложение F (справочное)
Документация аттестации эксплуатации. Руководство для медицинских учреждений Примечание - Пользователям форм, предложенных в данном приложении, разрешается делать копии этих форм, при этом за ИСО остаются все другие права, относящиеся к этому документу в целом.
F.1 Контрольный лист аттестации эксплуатации (OQ): процесс термосклеивания
Количество оцененных образцов
F.2 Контрольный лист аттестации эксплуатации (OQ): процесс обертывания
Количество оцененных образцов
F.3 Контрольный лист аттестации эксплуатации (OQ): процесс с использованием контейнера
Количество оцененных образцов
Приложение G (справочное)
Документация аттестации эксплуатируемого оборудования. Руководство для медицинских учреждений Примечание - Пользователям форм, предложенных в данном приложении, разрешается делать копии этих форм, при этом за ИСО остаются все другие права, относящиеся к этому документу в целом.
G.1 Контрольный лист аттестации эксплуатируемого оборудования (PQ): процесс склеивания
Критерии качества
G.2 Контрольный лист аттестации эксплуатируемого оборудования (PQ): процесс обертывания
Критерии приемки
G.3 Контрольный лист аттестации эксплуатируемого оборудования (PQ): процесс с применением контейнера
Критерии приемки
Приложение Н (справочное)
Требования к использованию условий наиболее худшего случая. Руководство для промышленных и медицинских учреждений Н.1 Общее представление ИСО 11607-1 рассматривает наихудший случай в трех областях, и в каждом случае это означает что-то немного другое. Чтобы правильно интерпретировать и применять разделы, описывающие наихудший случай, важно понимать используемую терминологию.
А именно:
- барьерная система для стерилизации - минимальная упаковка, которая предотвращает доступ микроорганизмов и позволяет осуществить асептическое извлечение медицинского изделия в месте использования;
- защитная упаковка - конфигурация материалов, предназначенных для защиты барьерной системы для стерилизации и ее содержимого от повреждения с момента сборки (упаковочной) системы до места использования (содержимого);
- упаковочная система - сочетание барьерной системы для стерилизации и защитной упаковки.
Н.2 Конфигурация в наихудшем случае. Медицинские изделия В ИСО 11607-1:2006, подпункт 6.1.6, указано: "Если для аналогичных медицинских изделий использована одна и та же упаковочная система, следует документально оформить обоснование для установления сходства и идентификации конфигурации упаковки при наихудших допустимых условиях применения. Как минимум, следует использовать конфигурацию при наихудших допустимых условиях, чтобы определить соответствие настоящему стандарту".
В пределах семейств медицинских изделий (т.е. медицинских изделий, которые схожи, но не идентичны) общую барьерную систему для стерилизации можно использовать для защиты целого ряда медицинских изделий. Наихудший допустимый вариант определяют путем идентификации медицинского изделия (изделий), которое создает наибольшее напряжение для упаковочной системы. Наихудший допустимый вариант конфигурации может представлять собой наиболее громоздкое и тяжелое изделие в обычной группе медицинских изделий или изделие с наибольшим числом сборных элементов или других особенностей. Зачастую определение наихудшего допустимого варианта конфигурации понятно. Однако в некоторых случаях может потребоваться испытание нескольких медицинских изделий (например, самого тяжелого изделия, а также изделия с наибольшим числом сборных элементов), чтобы обеспечить полную проверку системы на прочность. Правильная характеристика и оценка наихудшего допустимого варианта конфигурации обеспечит надежную защиту всем другим медицинским изделиям семейства со стороны рассматриваемой упаковочной системы.
Н.3 Наихудший допустимый вариант. Барьерная система для стерилизации Дополнительное указание, касающееся испытаний наихудшего допустимого варианта, представлено в ИСО 11607-1:2006, подпункт 6.3.4, на эксплуатационные испытания упаковочной системы: "Эксплуатационные испытания должны проводить на барьерной системе, применяемой в наихудших условиях, которая изготовлена в заданных производственных пределах формирования и склеивания упаковки и после воздействия на нее всех установленных процессов стерилизации". Существует два доминирующих подхода, касающихся ключевых вопросов данного раздела.
Первый и наиболее общий подход заключается в выборе предварительно сформированных барьерных систем для стерилизации, изготовленных с использованием полностью валидированного процесса. Барьерные системы для стерилизации, которые произведены серийно, партиями в типичных рабочих условиях в рамках окна валидации, испытывают и оценивают. Путем выбора подходящего размера выборки из нескольких партий (обычно трех) один можно подтвердить на заданном доверительном уровне, чтобы был представлен полный диапазон характеристик упаковки (например, прочность клеевого соединения). Следовательно, выбор объема выборки и числа оцениваемых партий является важным компонентом документально оформленного обоснования. Существует множество стандартных образцов, которые помогают определению размера выборки.
Второй подход включает изготовление барьерных систем для стерилизации в производственных условиях наихудшего случая, обычно это экстремальные значения в окне валидации. В некоторых случаях барьерные системы могут изготавливаться при наименьшей температуре, наименьшем давлении и минимальной продолжительности (склеивания), допускаемыми валидацией, чтобы получить барьерные системы для стерилизации с качествами клеевого соединения, соответствующими наихудшему случаю в нижней границе допустимого интервала. Обычно параметры, используемые для установления OQ, используются для производства барьерных систем для стерилизации, которые необходимы для оценки эффективности упаковочной системы. Этот подход может оказаться затратным, поскольку потребуется произвести конкретные и отдельные партии изделий для создания барьерных систем для стерилизации в наихудших условиях производства.
И в том и в другом подходе выполнение конечного клеевого соединения для закрытия (на предварительно сформированной барьерной системе для стерилизации, системе лоток-крышка или по технологии формирования - наполнения-укупорки) при крайних или за пределами крайних установленных значений параметров процесса склеивания, чтобы обеспечить производство барьерной системы для стерилизации в наихудших допустимых условиях.
Подход, предусматривающий достижение соответствия ИСО 11607-1, будет зависеть от изготовителя медицинского изделия, но в каждом случае выбранный подход необходимо поддержать подходящим обоснованием, который включают в документально оформленный протокол валидации упаковки. Выбор будет зависеть от политики корпоративного риска и экономических проблем.
Н.4 Наихудший допустимый вариант конфигурации упаковки. Процесс изготовления барьерной системы для стерилизации
Наихудший допустимый вариант конфигурации снова обсуждается в ИСО 11607-2:2006, подпункт 5.1.5: "После валидации процессов производства предварительно отформованных барьерных систем и барьерной системы для стерилизации необходимо документально оформить обоснование для установления подобия и идентификации конфигурации в расчете по наихудшему варианту. Как минимум, необходимо проводить валидацию конфигурации в расчете по наихудшему варианту для установления соответствия с настоящим стандартом". В этом случае наихудший допустимый вариант конфигурации применяют к процессам производства барьерных систем для стерилизации, а не самого медицинского изделия. При валидации производственных процессов (предварительно сформированные) барьерные системы для стерилизации можно сгруппировать в семейства, например пакеты с зигзагообразной выработкой, в которых для верха и низа используется одинаковый материал, но различного размера. Чтобы обеспечить значимость валидации для всего семейства барьерных систем для стерилизации, необходимо идентифицировать наихудший допустимый вариант конфигурации семейства (предварительно сформированных) барьерных систем. При термосклеивании важно рассмотреть края площади клеевого соединения. Например, и большие, и малые площади склеивания на пакетах, блистерных упаковках представляют одинаковые проблемы и требуют оценки. Для термоформования лотков и крышек можно рассмотреть общее количество квадратных сантиметров склеиваемой массы (т.е. общее количество квадратных сантиметров под склеивающей пластиной). Такой подход позволит оценить влияние недостаточного или избыточного проклеивания, а также распределение давления и температуры.
Важно также учесть, что наихудший допустимый вариант конфигурации упаковки для склеивания может не совпасть с наихудшим случаем для валидации стерилизации.
Приложение I (справочное)
Составление протокола валидации конечной упаковочной системы. Руководство для промышленных предприятий Примечание - Валидация конечной упаковочной системы, включающей барьерную систему для стерилизации и защитную упаковку, включает разработку соответствующего протокола валидации, исполнение этого протокола и критического анализа результатов испытания, чтобы определить, удовлетворяются ли предъявляемые к упаковочной системе требования (ИСО 11607-1:2006, пункты 4.3, 6.3 и 6.4).
I.1 Плановые задачи и исходные данные для разработки протокола Критическим элементов процесса валидации является документальное оформление плана испытаний упаковочной системы. Обычно это делается посредством составления подробного протокола, в котором описываются поставленные задачи, детали конструкции упаковочной системы, план(ы) выборочного контроля, заданный срок годности барьерной системы для стерилизации или упаковочной системы, методы испытания и оборудование для их осуществления, критерии приемки и другая относящаяся к делу информация. Протокол должен быть достаточно подробным, чтобы ведущий испытания инженер мог понять, что следует делать для выполнения требований валидации.
В протоколе будут описаны методы испытаний, подходящие для оцениваемого типа упаковочной системы, включая методы испытания целостности упаковки (барьерной системы для стерилизации). (Дополнительное обсуждение методов испытания можно найти в приложениях А и О.) Следует выбрать соответствующий метод жесткого варианта обращения и отгрузки, чтобы реалистично подтвердить целостность упаковочной системы (барьерной системы для стерилизации) и обеспечить высокую вероятность того, что барьерная система для стерилизации и упаковочная система достигнут места применения в пригодном для использования состоянии. В протоколе следует указать требования к сроку годности упакованного медицинского изделия и метод верификации этого аспекта проектирования упаковочной системы (дополнительную информацию по использованию ускоренного старения для оценивания срока годности барьерной системы для стерилизации или упаковочной системы см. в приложении А). Размер выборки для всех методов испытания должен быть достаточно большим, чтобы обеспечить значимый статистический анализ и гарантировать высокую степень надежности. После разработки протокола для проектирования и оценивания упаковочной системы требуется утверждение всех затронутых сторон перед началом испытаний, которое, как все аспекты протокола, необходимо задокументировать.
Примечание - Разработка барьерной системы для стерилизации является балансом имеющегося времени и ресурсов, и может оказаться, что параметры производства упакованного медицинского изделия будут корректироваться в процессе исполнения протокола. Опытные компании применяют гибкий подход, но всегда документируют все изменения проекта или процесса с аргументированным обоснованием.
I.2 Понимание проектируемой конфигурации упаковочной системы Важным аспектом валидации проекта упаковочной системы является понимание различных уровней упаковывания, которые могут быть использованы. Полная упаковочная система может включать барьерную систему для стерилизации (например, пакет или лоток), дополнительные уровни защитной упаковки (например, картон, готовая упаковка), а также отгрузочную тару. При испытании определенным индикатором приемки проекта упаковочной системы является поддержание барьерной системы для стерилизации (первичной упаковки), которая оценивается, исходя из результатов испытания целостности. Кроме того, вторичный и третичный уровни упаковывания, которые обеспечивают раскладку, маркировку и защитные функции, зачастую могут оцениваться по отдельности по протоколу, поскольку вносят свой вклад в эффективность всей упаковочной системы.
Перед подготовкой протокола валидации обычно оценивают биосовместимость барьерной системы для стерилизации. Изготовитель медицинского изделия должен учитывать любые потенциальные взаимодействия медицинское изделие/упаковочная система (если применимо) перед вложением средств на валидацию барьерной системы для стерилизации.
I.3 Группировка упаковочных систем для валидации При определении и оценивании упаковочной системы необходимо обдумать другие конструкции упаковочной системы и медицинских устройств, которые могут потребовать валидации. В большинстве случаев схожие медицинские изделия, образующие семейство медицинских изделий, можно валидировать вместе там, где упаковочные материалы, упаковочное оборудование, процессы стерилизации и другие аспекты использования и срока годности медицинских изделий похожи. Можно порекомендовать выбор комбинации изделие/упаковочная система, которая представляет наихудший случай, чтобы обеспечить менее требовательные варианты барьерной системы для стерилизации и соответствующего медицинского изделия. Во всех таких случаях протокол должен включать обоснование для применяемого подхода. Иногда также возможно приспособить существующие упаковочные системы к медицинским изделиям, чтобы уменьшить сложности с протоколом валидации или чтобы провести валидацию по сценарию наихудшего случая, который охватит множество комбинаций упаковочная система/медицинское изделие. Медицинские изделия со схожими физическими размерами и/или конфигурации упаковочных систем, схожих с прошедшими валидацию конструкциями, могут дать основу для веского основания ограничить количество испытаний, требующихся для установления эффективности барьерной системы для стерилизации.
I.4 Определение размера выборки для валидации конечной упаковочной системы Выбранный размер выборки будет зависеть от упаковочной системы, подлежащей испытанию (например, барьерная система для стерилизации, защитные упаковки, транспортная коробка), типа реакции на испытание (качественная характеристика или переменная) и вопросов, связанных с приемлемыми уровнями риска (ИСО 11607-1:2006, пункт 4.3).
а) Для барьерной системы для стерилизации, которая в первую очередь будет определять приемлемость всей упаковочной системы, испытания следует выполнять, используя размер выборки, который обеспечит получение статистически значимых данных.
б) Для качественных данных (например, пройдено/не пройдено) размер данных будет зависеть от желаемого уровня доверия и желаемой надежности результата.
в) Для переменных данных в испытаниях, где получают реальное значение, в противоположность результату пройдено/не пройдено требуется выборка меньшего размера, чтобы получить статистически значимое значение. Поэтому рекомендуется там, где возможно, превратить испытания качественные в испытания количественные (например, используя шкалу оценок), чтобы уменьшить требуемый размер выборки.
г) Транспортная коробка, которая будет вмещать индивидуальные барьерные системы для стерилизации либо вторичные или третичные коробки, может иметь несколько размеров выборки, начиная с одного образца, если в одной транспортной коробке содержится достаточное количество барьерных систем для стерилизации, чтобы выполнять адекватные параллельные опыты в испытаниях упаковочной системы.
Примечание - Для единицы испытуемой конфигурации, например упаковочной системы, содержащей двенадцать (12) барьерных систем для стерилизации, размер выборки составит не двенадцать (12), а один (1) образец, а каждая барьерная система будет являться 1/12 целого образца.
I.5 Определение критериев приемки Критическим компонентом валидации является определение, что составит положительный результат валидации. Следует установить критерии приемки до начала валидации и сконцентрироваться на поставке медицинского изделия конечному пользователю в неповрежденном и стерильном состоянии. Детальные критерии приемки могут позволить допуск на повреждение медицинского изделия или его упаковочной системы. Форма и содержание приемочных критериев могут меняться в широком диапазоне в зависимости от конкретной ситуации. Методы могут меняться от простого критерия пройдено/не пройдено до исключительно количественных критериев или систем анализа. Внесенные в протокол приемочные критерии и технические условия на упаковочную систему тесно связаны, хотя протокол исследует больше аспектов упаковочной системы, чем обычно отслеживают в процессе повседневного производства.
I.6 Подготовка барьерной системы для стерилизации к испытаниям Барьерные системы для стерилизации, представленные для валидации проекта упаковочной системы, изготавливают в соответствии с типовыми рабочими инструкциями (SOP). Упаковочные системы требуют стерилизации с помощью прошедшего валидацию процесса стерилизации. Стерилизацию можно превратить в процесс, проходящий в наихудших допустимых условиях, посредством выполнения нескольких циклов стерилизации. Упаковочные системы должны содержать реальное медицинское изделие или его имитацию, нести соответствующую маркировку, a IFU (инструкции по применению) вкладывают уже в конечную, выпускаемую на рынок упаковочную систему (см. DIN 58921).
I.7 Определение условий транспортирования На основе вводных данных при проектировании, касающихся глобальной логистики и распределения, ожидаемых для рассматриваемого медицинского изделия, определяют испытание на обращение и транспортирование (ИСО 11607-1:2006, пункт 5.5). Это испытание можно спланировать с помощью различных средств:
- реальная отгрузка (см. примечание);
- стандартизованная имитация в лаборатории;
- лабораторные имитации на основе измеренных полевых данных;
- воздействие окружающей среды (климатическое воздействие) в зависимости от рассматриваемого случая.
Руководство по выбору подходящего метода испытания, связанного с проблемами распределения, см. ASTM D4169. Для дополнительной информации по экологическим проблемам см. приложение А.
Примечание - Не рекомендуется использовать реальное транспортирование как единственный метод оценки. Обычно не существует возможности документально подтвердить, в каком режиме происходила перевозка, в более жестких или менее жестких условиях.
I.8 Определение срока годности
Одним из важных аспектов протокола валидации являются обоснование и параметры испытания для установления срока годности медицинского изделия (ИСО 11607-1:2006, пункт 6.4). Если указано на упаковочной системе медицинского изделия, Управление контроля качества FDA требует документально подтвержденного свидетельства, чтобы поддержать заявленные даты окончания срока годности. Европейский союз требует указывать даты окончания срока годности на упаковках всех медицинских изделий в соответствии с Директивой ЕС Directive 93/42/ЕЕС, которая постановляет, что "требуется в соответствующем месте нанести маркировку с указанием даты (года и месяца), до которой можно использовать медицинское изделие безопасно".
Использование ускоренного старения для испытания срока годности барьерной системы для стерилизации обычно принимается как действующее для внедрения новых медицинских изделий при условии, что естественное старение в условиях эксплуатации подтвердит данные, полученные при ускоренном старении. Протокол ускоренного старения следует разрабатывать на основе консервативной температуры, которую выбирают так тщательно, чтобы материалы (как медицинского изделия, так и упаковочной системы) не были повреждены в результате экстремальных условий, выходящих за границы допустимого диапазона для использования этих материалов. Обычно выполняют серию испытаний для оценивания целостности упаковки (барьерной системы для стерилизации), особенностей вскрытия (если имеются) и общих свойств самих упаковочных материалов.
Для обсуждения испытания на стабильность см. приложение М, подпункт 4.8.2.
Примечание - Дополнительную информацию можно найти в нормативно-техническом документе EU-MEDDEV 2.2/3. Приложение J (справочное)
Вводные данные проектирования. Качественные характеристики медицинских изделий. Руководство для промышленных предприятий J.1 Введение Прежде чем приступить к проектированию упаковочной системы для медицинского изделия, подлежащего финишной стерилизации, важно изучить все качественные характеристики медицинского изделия и требования к нему, которые могут повлиять на проектирование упаковочной системы (ИСО 11607-1:2006, раздел 6). Наилучший способ выполнить это для ответственных за проектирование упаковочной системы заключается в участии в полной разработке продукта, начиная с самой ранней стадии. Получение необходимой информации, требуемой для начала процесса проектирования, должно быть кросс-функциональной деятельностью, требующей взаимодействия ряда организаций. Эти организации включают (не ограничиваясь этим) технические, производственные, маркетинговые и регулирующие организации.
На высоком уровне вводные данные проектирования можно представить как качественные характеристики продукции и конкретные требования в ней. Качественные характеристики продукции - это обычно физические характеристики медицинского изделия, которое необходимо упаковывать. Конкретные требования к продукции можно разделить на несколько категорий. Эти категории являются требованиями к защите продукции, требованиями к производству, требованиями к процессу стерилизации, требованиями к обращению, хранению и распределению, требованиями к маркетингу, бюджетными требованиями, требованиями потребителя и требованиями регламентов. Каждая из этих категорий взаимосвязана с другими, развивается параллельно циклу развития продукции и играет роль в определении конструкции конечной упаковочной системы.
Каждая из этих категорий будет обсуждена в приложении J, чтобы обеспечить базовое руководство по сбору вводных данных перед проектированием упаковочной системы для медицинских изделий, подлежащих финишной стерилизации.
J.2 Характеристики продукции
Первый этап сбора вводных данных проектирования включает анализ характеристик медицинского изделия. Это физические характеристики медицинского изделия, которые помогут в принятии некоторых основных решений, касающихся типа упаковочной системы, требующейся для помещения медицинского изделия.
Физические характеристики включают (но этим не ограничиваются):
a) Размер: Под размером медицинского изделия следует понимать длину, ширину, диаметр и профиль медицинского изделия и комплектующие, которые являются частью целого изделия.
b) Масса: Определяют общую массу медицинского изделия и всех комплектующих, подлежащих упаковыванию.
c) Центр тяжести: Определяют сохраняет ли медицинское изделие равновесие или смещается, что поможет определить ориентацию медицинского изделия в упаковочной системе.
d) Профиль: Определяют профиль медицинского изделия и всех комплектующих.
e) Острые кромки/концы: Определяют наличие острых кромок и концов на медицинском изделии и комплектующих, которые могут повредить барьерную систему для стерилизации. Также определяют, требуется ли защита пользователю или лицу, которое будет вскрывать упаковочную систему от острых кромок и концов на медицинском изделии и комплектующих.
f) Характеристики поверхности: Определяют, требуется ли специальная защита поверхностей медицинского изделия и комплектующих. Например, будет ли это медицинское изделие с покрытием или с шероховатой поверхностью, которая поцарапает барьерные материалы системы для стерилизации, или полированное медицинское изделие, которое может изнашиваться под действием материалов барьерной системы для стерилизации.
g) Срок годности: Важно понимать, имеет ли медицинское изделие дату истечения срока действия. А также можно ли продлить срок годности при наличии данных дополнительной валидации.
h) Способность к изменению конфигурации: Определяют, можно или нет манипулировать медицинским изделием, чтобы приспособить его под упаковочную систему. Некоторые упаковочные системы требуют поместить внутрь медицинское изделие, соблюдая определенную ориентацию. Способность медицинского изделия к трансформированию часто дает возможность уменьшить размер упаковочной системы.
J.3 Руководство по защите медицинского изделия
Одной из главных функций упаковочной системы является защита медицинского изделия до места использования. Чтобы спроектировать эффективную и экономичную упаковочную систему для медицинского изделия, следует провести оценку чувствительности медицинского изделия. Чувствительность, наряду с такими факторами, как обработка при изготовлении, стерилизация и обращение при распределении и в месте использования, помогут определить требования к общей защите медицинского изделия в целом. Понимание этих требований поможет принять решение, касающееся выбора материала для барьерной системы и для защитной упаковки.
Оценка требований к защите медицинского изделия должна, как минимум, рассмотреть следующее:
a) Чувствительность к температуре: Определяют, существуют ли какие-либо ограничения по воздействию на медицинское изделие крайних температур разрешенного диапазона. Это поможет определить, потребует ли медицинское изделие контролируемых окружающих условий при распределении.
b) Влага/влажность: Определяют, существуют ли какие-либо ограничения по воздействию на медицинское изделие крайних значений влажности.
c) Свет: Определяют, существуют ли какие-либо ограничения по воздействию на медицинское изделие ультрафиолетовых (УФ) лучей или света видимой части спектра.
d) Кислород: Определяют, чувствительно ли медицинское изделие к кислороду.
e) Удар: Определение интенсивности соударений, которые может получить медицинское изделие без упаковки, поможет определить степень защиты от ударов, которая потребуется от упаковочной системы. Также важно понимать, будет ли медицинское изделие одинаково восприимчиво к силе ударов в определенной ориентации.
f) Вибрация: Определяют, чувствительно ли медицинское изделие к вибрации. Часто при проектировании упаковочной системы помогает знание резонансной частоты медицинского изделия. Это поможет определить степень требующейся защиты.
J.4 Руководство по хранению, распределению и обращению
J.4.1 Проектировщик упаковочной системы должен понимать, какие напряжения испытывает упаковочная система на протяжении своего жизненного цикла. Сюда входят все факторы хранения, распределения и обращения. Требования к условиям хранения, распределения и обращения определяют главным образом по типу медицинского изделия, типу упаковочной системы и типу распределения. Полное понимание этих факторов поможет рассмотреть все требования к необходимой защите медицинских изделий.
J.4.2 Оценка требований к хранению, распределению и обращению, должна, как минимум, включать следующее:
a) Хранение: Проводят полную оценку условий хранения. Эта оценка должна включать условия хранения на производственных предприятиях, в распределительных центрах и у конечного пользователя. Ключевыми факторами являются ограничения пространства, проблемы складирования или штабелирования и воздействие температуры/влажности. Условия хранения у конечных пользователей оценить сложнее, в то же время, как минимум, должно существовать понимание всего разнообразия условий хранения медицинского изделия конечным пользователем. Сюда можно включить хранение в больнице, в региональном центре, или медицинские изделия развозят по клиникам торговые организации.
b) Распределение/транспортирование: Проводят оценку условий распределения. Полная оценка распределения может оказаться трудоемкой и затратной, однако необходимо в основном понимать факторы, включенные в распределение, чтобы спроектировать эффективную и экономичную упаковочную систему. Определяют такие основные факторы, как средства транспортирования, используемые для перевозки медицинских изделий между: производственным предприятием, удаленным или контрактным учреждением, выполняющим стерилизацию (если участвует); центром распределения и потребителем. Оценка распределения должна также включать распределение потребителям. Способы выполнения всех перемещений медицинского изделия являются критическими вводными данными проектирования.
c) Обращение: Проводят оценку условий обращения с медицинским изделием. Эта оценка включает несколько факторов от условий изготовления, распределения и потребителя. Требования к защите медицинского изделия зачастую непосредственно связаны с тем, как обращаются с медицинским изделием, вручную или с помощью машинных средств. Средства для обращения с медицинским изделием обычно определяются конфигурацией его упаковки, от того, является ли она отдельным предметом или единицей на поддоне, и как она поступает на место использования.
J.5 Руководство по изготовлению
J.5.1 Прежде чем приступить к проектированию упаковочной системы для медицинского изделия необходимо изучить технологические процессы, которым будут подвергаться медицинское изделие и упаковочная система. Проектировщик должен понимать все процессы, вовлеченные в формирование, склеивание и маркировку упаковочной системы.
J.5.2 Оценка требований к изготовлению должна включать, как минимум, следующее:
а) Место: Определяют, где медицинское изделие будет производиться и упаковываться. Сюда может входить несколько мест, если медицинское изделие, компоненты сборки или сырьевые материалы должны перемещаться между предприятиями перед финишным упаковыванием. Место оценивают, чтобы определить, существуют ли факторы окружающей среды, которые необходимо оценить для определения среди них факторов, оказывающих влияние на принятие решений относительно проектирования упаковочной системы. Также, если одно и то же медицинское изделие планируется производить в нескольких местах, необходимо идентифицировать все существующие различия между предприятиями.
b) Оборудование: Необходимо провести полную оценку имеющегося упаковочного оборудования, чтобы спроектировать эффективную и экономичную упаковочную систему. В ходе такой оценки определяют возможности для проектирования упаковочной системы, совместимой с существующим оборудованием. Также идентифицируют все зазоры, которые необходимо заполнить путем приобретения дополнительного упаковочного оборудования.
c) Валидация: Ключевым компонентом развития производственных процессов для барьерных систем для стерилизации являет* валидация процесса. Время и стоимость мероприятий по валидации для формирования, склеивания и сборки барьерной системы сначала должны обсуждаться в проекте барьерной системы.
d) Обучение: Для проектирования новых барьерных систем следует рассмотреть время и стоимость мероприятий по обучению операторов собирать упаковочную систему или управлять оборудованием по сборке.
J.6 Руководство по процессу стерилизации Прежде чем проектировать упаковочную систему, необходимо понимать процесс стерилизации медицинского изделия. Знание процесса стерилизации поможет руководить ключевыми решениями, касающимися материалов конструкции для барьерной системы для стерилизации. Дополнительную информацию по требованиям к процессу стерилизации и ссылкам можно найти в приложении В.
J.7 Руководство по маркетингу J.7.1 Проектировщик упаковки должен понимать основные принципы маркетинга медицинского изделия. Базовый план маркетинга обеспечит обработку данных, касающихся потребителей, рынков и места рассматриваемого изделия в общем плане по медицинским изделиям. Эта информация будет использоваться для продвижения ряда ключевых решений относительно проектирования упаковочной системы.
J.7.2 Оценка требований к маркетингу медицинского изделия должна, как минимум, включать следующее:
a) Потребители: План маркетинга может дать основную аналитическую информацию о том, кто будет пользоваться рассматриваемой упаковочной системой. Факторы, касающиеся потребителя, как использовать упаковочную систему, помогут принять основные решения относительно проектирования упаковочной системы.
b) Рынки: План маркетинга определит, на какие рынки можно предлагать рассматриваемое медицинское изделие и в конечном итоге продавать. Это можно использовать для определения конкретных требований страны относительно материалов, маркировки и распределения, которые могут повлиять на проектирование упаковочной системы.
c) Конфигурация: План маркетинга может диктовать, как упаковывать медицинское изделие: отдельными единицами, в групповой таре (мультипак) или даже как часть набора с другими медицинскими изделиями. Обычно маркетинг определяет необходимость в этих конфигурациях на основе предполагаемого объема, запуска в производство, средней продажной цены на предполагаемых рынках и логистики, связанной с распределением. Хотя проектировщик упаковочной системы иногда не участвует в принятии решений, они являются ключевыми вводными данными для проектирования упаковочной системы.
J.8 Руководство по бюджету J.8.1 Общим фактором для всех проектов, касаются ли они проектирования упаковочной системы для медицинских изделий, подлежащих финишной стерилизации, или нет, является бюджет. Прежде чем проектировать упаковочную систему для медицинского изделия, необходимо полное понимание бюджета для проектирования этой упаковочной системы. Понимание бюджета поможет руководить принятием всех важных решений на всех этапах проектирования упаковочной системы.
J.8.2 Оценка требований бюджета должна, как минимум, включать следующее:
a) Материал: Определяют соответствие затрат на выбранные материалы упаковочной системы медицинскому изделию. Дополнительно рассматривают затраты на необходимые установочные материалы.
b) Производство: Определяют затраты, связанные со сборкой упаковочной системы. Сюда входят затраты на инструментарий, оборудование, аренду помещения, накладные расходы и оплату труда.
c) Цепочка поставок: Определяют расходы, связанные с отсылкой медицинского изделия через систему распределения. Сюда входит стоимость перевозок между предприятиями, перевозок в центры распределения и отправки потребителю.
J.9 Руководство по потребителям J.9.1 Проектировщик упаковочной системы должен понимать основные требования, касающиеся упаковочной системы для медицинских изделий, подлежащих финишной стерилизации. Основные требования заключаются в том, что барьерная система для стерилизации как часть упаковочной системы нуждается в поддержке стерильной целостности и предусматривает асептическое извлечение содержимого в месте использования. Кроме того, оценка требований к потребителю может оказаться сложным процессом. В то же время, чтобы спроектировать эффективную упаковочную систему, важно как можно лучше понимать потребителя и знать окружающую его среду.
J.9.2 Оценка требований к потребителю должна включать, как минимум, следующее:
а) Потребитель: Важно понимать, кто будет пользоваться упаковочной системой. Для медицинского изделия, подлежащего финишной стерилизации, это зачастую техник операционной, но в то же время это могут быть разные работники в разных обстоятельствах. Понимание максимальных требований к потребителю поможет в процессе принятия решений о проектировании.
b) Окружающая среда потребителя: Определяют условия в месте использования, в котором будет вскрываться барьерная система для стерилизации. Для медицинского изделия, подлежащего финишной стерилизации, обычно это операционная или больница. Часто окружающие условия оказываются стрессовыми, ускоряющими разрушение изделия, поэтому следует предпринять определенные меры, чтобы использование упаковочной системы не вносило дополнительного напряжения в атмосферу применения изделия.
c) Легкость вскрытия: Барьерная система для стерилизации должна легко вскрываться, чтобы извлечь медицинское изделие, не нарушая асептики. Это основной принцип упаковывания стерильного медицинского изделия. Если барьерную систему вскрыть сложно, увеличивается риск контаминации. При нарушении стерильности медицинского изделия применять такое изделие не допускается.
d) Идентификация медицинского изделия: Рассматривают все требования к идентификации медицинского изделия, конкретно относительно потребностей потребителя или те, которые помогут потребителю в среде использования этого изделия. Дополнительную информацию и ссылки на требования к идентификации медицинского изделия можно найти в приложении N.
J.10 Руководство по регламентам
Важно понимать пути регулирования рынков для распределения медицинских изделий. Требования разрешения от регулирующих органов часто различаются в разных регионах и могут повлиять на процесс принятия решения при проектировании упаковочной системы. Дополнительную информацию по требованиям регламентов и ссылкам можно найти в приложении N. Приложение К (справочное)
Механизмы анализа риска. Руководство для промышленных предприятий и медицинских учреждений К.1 Приложения Существует множество приложений для анализа риска, которые могут включать:
К.1.1 Использование/приложения/система: Этот анализ рассматривает упакованное медицинское изделие с позиции пользователя, получившего это медицинское изделие:
a) понимания требований и опасений пользователя;
b) легкость применения, т.е. вскрытия/извлечения;
c) понимания приложений медицинского изделия и вредные факторы;
d) ошибочный порядка использования медицинского изделия.
К.1.2 Проект: Процесс анализа проекта позволяет разработчикам рассчитать и предусмотреть в медицинском изделии и упаковочной системе качество и надежность, зная потенциальные недостатки, которых пытаются избежать. Перечень потенциальных видов отказа спроектированной конструкции:
a) обработка;
b) стерилизация;
c) распределение;
d) взаимодействие людей;
e) рассмотрение уникальных видов отказа;
f) рассмотрение конкретных отказов барьерных характеристик.
К.1.3 Процесс: Технологический процесс может внести серьезный вклад в потенциальные отказы на месте (использования). Анализ процесса идентифицирует потенциальные отказы, которые необходимо рассмотреть в процессе разработки медицинского изделия:
a) оборудование (разнообразие установочных параметров);
b) материалы (изменчивость от партии к партии);
c) окружающая среда (изменчивость от места к месту);
d) персонал (квалификация/опыт).
К.2 Механизмы анализа риска
К.2.1 Анализ видов и последствий отказов (FMEA): Эта методология помогает ранжировать возможные отказы, которые могут потребовать дополнительного внимания или более глубокого анализа. Анализ FMEA обеспечивает упорядоченный анализ конкретной функции для идентификации и классификации по серьезности известных или потенциальных видов отказа до того, как они случатся. Типичные шаги FMEA включают:
a) идентификацию важных функциональных этапов, т.е. процесса;
b) перевод характеристик в формат потенциальных видов отказа;
c) идентификацию потенциальных последствий и причин взаимосвязанного (вторичного) отказа;
d) определение текущего контроля;
e) присвоение категории жесткости, частоты появления и выявления;
f) расчет RPN (категория приоритета уровня риска);
g) систематизацию RPN (формат Парето) и определение рекомендуемого действия;
h) регистрацию предпринятого действия и определение результирующей RPN;
i) последующую деятельность.
К.2.2 Анализ методом дерева отказов (FTA): Анализ FTA является дедуктивным, "нисходящим" подходом к анализу видов отказов. Он обеспечивает логический структурированный процесс, который может идентифицировать отказ и его последствия до того, как он реально произойдет. Типичные этапы FTA включают:
a) перечень возможных опасностей;
b) определение отказов или комбинации отказов, что приведет к именованным опасностям;
c) подготовку диаграммы дерева отказов;
d) использование дерева отказов для прерывания проектирования или исключения из проекта неприемлемых последствий.
К.2.3 Анализ рисков и определение критических контрольных точек (НACCP=ХАССП): ХАССП является систематическим подходом к идентификации, оцениванию и контролю рисков. Типичные этапы ХАССП включают:
a) проведение анализа степени рисков;
b) определение критических контрольных точек (ССР);
c) установление критических пределов;
d) разработку процедур мониторинга;
е) установление корректирующих действий;
f) разработку процедур верификации;
g) разработку процедур хранения записей и документации. Приложение L (справочное)
Обсуждение планов выборочного контроля. Руководство для медицинских учреждений ИСО 11607-1:2006 и ИСО 11607-2:2006 устанавливают в пункте 4.2:
Планы выборочного контроля, используемые для выбора и испытаний упаковочных систем, должны быть применимы к оцениваемым упаковочным системам. Планы выборочного контроля должны быть основаны на статистически значимом обосновании.
Примечание - Примеры подходящих планов выборочного контроля приведены в ИСО 2859-1 или ИСО 186. В отдельных странах и регионах могут быть установлены планы дополнительного выборочного контроля.
В медицинских учреждениях постоянно возникают вопросы, связанные с требованиями статистически значимого плана выборочного контроля: что это означает и как это обосновать? В приложении L дается руководство, как ответить на эти вопросы в отношении барьерных систем однократного и многократного применения. Если ваше медицинское учреждение не имеет накопленного опыта по статистике, рабочая группа, разрабатывающая этот документ, предложила бы обратиться за помощью к специалисту по статистике. Кроме того, значительный объем информации имеется в Интернете, для поиска по ключевым словам "планы выборочного контроля" или "размер выборки". Существует семь программ на веб-узле, по которым можно рассчитать объем выборки после ввода требующейся информации.
Цель плана выборочного контроля заключается в обеспечении уверенности, что предварительно определенные критерии приемки удовлетворяются не только в образцах, но и всеми множествами или партиями, произведенными по этой технологии. Одним из способов является испытание каждого члена множества или партии. Например, если вы стерилизовали загрузку, включающую 50 медицинских изделий в обертке, то контроль всех упаковок является статистически общезначимым обоснованием. Другой способ заключается в отборе (для контроля) меньшего числа упаковок. Однако если вы решили проверить только одно упакованное изделие, это даст недостаточно информации, чтобы обеспечить соответствие остальной части загрузки. Аналогично, если одно упакованное изделие, которое проверили, оказалось неприемлемым, то надо будет переделывать всю загрузку?
Гарантированный уровень стерильности (SAL) является результатом стерилизации и обычно предполагает определенную степень дезактивации микробов, произведенную за счет процесса стерилизации, использующего нагревание, химические вещества, облучение или сочетание этих средств. SAL не подразумевает применения других аспектов безопасности, как уровень дезактивации в ходе процесса стерилизации, описания уровня безопасности для сохранения стерильности после стерилизации. На поддержание стерильности влияет сама СБС, но главным образом практикуемые процедуры обращения и хранения в медицинском учреждении. Поэтому медицинскому учреждению потребуется определить эти процедуры и способ и уровень безопасности для верификации.
Существует ряд факторов, которые следует учесть при разработке планов выборочного контроля с целью определения соответствия всего множества или всей партии упаковок предварительно определенным критериям.
- Число упаковок в совокупности или партии. Если ваше учреждение имеет упакованный продукт и вы производите только 1 шт. в месяц, единственным общезначимым планом выборочного контроля является испытание каждой упаковки. В то же время если учреждение производит упакованный продукт, а совокупность или партия составляет 1000 шт. в месяц, то будет неэкономно испытывать каждую из них, поэтому разработанный план выборочного контроля уменьшает расходы за счет испытания только части совокупности или партии.
- Способ производства партии и ее определение.
Примечание 1 - ИСО 2859-1 в первую очередь используют для непрерывной серии партий (см. ИСО 2859-1, пункт 1.2). В больницах, как правило, не производят непрерывной серии идентичных упаковок.
Примечание 2 - Больницы могут рассматривать формирование, склеивание и стерилизацию схожих концепций упаковки (например, пакетов) как серийное производство, несмотря на то что размеры и загрузки отличаются.
Следовательно, партия может рассматриваться как число произведенных упаковок в пределах определенного временного интервала (т.е. в день на человека, на упаковочный стол и т.д.)
- Тип данных, которые производит ваш метод испытаний. Данные могут быть непрерывными (число; например, прочность клеевого соединения) или дискретными (пройдено/не пройдено; например, визуальный контроль) и требуют разных статистических методологий и планов выборочного контроля. Например, ANSI/ASQ Z1.9 рассматривает переменные (непрерывные) данные, a ANSI/ASQ Z1.4 - дискретные (качественные) данные.
- Изменчивость (стандартное отклонение), которую производит метод испытания. Чем выше изменчивость, тем больше образцов надо испытать. Это одна из причин, по которой рабочая группа, разрабатывающая данный документ, рекомендует использовать методы испытаний с заявлениями о прецизионности и систематической погрешности (Р&В), которые демонстрируют изменчивость метода испытания.
-
Уровень риска, приемлемый в вашем
учреждении. Существует два типа рисков,
связанных с любым планом выборочного
контроля. Один риск заключается в приемке
совокупности или партии, даже если
несколько упаковок фактически не
соответствуют критериям приемки. Это
называется "риском потребителя",
или
- Расходы, связанные с планом выборочного контроля, зависят от плана и от испытаний. Если расходы слишком высоки, размер выборки можно уменьшить, при этом важно осознавать, что уровень риска увеличится.
Как указано выше, фактором, увеличивающим требующийся размер выборки, является изменчивость метода испытания, поэтому важно предпринять меры по сведению к минимуму изменчивости. Один из критериев успеха заключается в установлении детальных, четко определенных критериев приемки и методологии.
Требуется, чтобы для каждой испытуемой качественной характеристики существовали четкие критерии приемки. Визуальный контроль барьерных систем для стерилизации использовать легко. С его помощью можно просто убедиться, что упаковка цела.
Испытание на прочность клеевого соединения сформированных в вашем учреждении пакетов или рулонов требует установления верхнего и нижнего предельных значений. Если прочность клеевого соединения слишком низкая, целостность может нарушиться. Если прочность слишком высокая, то при вскрытии может произойти разрыв волокон или расслоение материалов. Часто за минимальное значение прочности клеевого соединения берут значение, установленное в критериях приемки, а тест на вскрытие вручную демонстрирует возможность асептического извлечения содержимого, и результат его используется как верхний предел. Имеется несколько способов достижения прочности клеевого соединения, и важно решить, каким методом это сделать, и придерживаться этого метода. Измерение прочности клеевого соединения с использованием трех разных методов позиционирования образца в испытательном устройстве может дать очень разные результаты. Также важно установить места для опробования. Поставщик пакетов, рулонов и оборудования для склеивания может предоставить информацию, которая поможет учреждению установить предельные значения.
При проведении OQ и PQ план выборочного контроля будет отличаться от повседневного плана для упаковок, выполненных в учреждении. Эти этапы предназначены для установления возможностей используемого процесса упаковывать изделие, а для достижения этого потребуется больше данных. Результаты OQ и PQ можно использовать для установления и оценки изменчивости. Это можно использовать для подготовки повседневных планов выборочного контроля [106]. Приложение М (справочное)
Испытание на стабильность (ИСО 11607-1:2006, пункт 6.4). Руководство для промышленных предприятий М.1 Упаковочная система с этикеткой или маркировкой, на которой указана дата окончания срока годности продукта, должна иметь данные о стабильности, которые демонстрируют, что клеевые соединения барьерной системы для стерилизации и материалы остаются достаточно стабильными, чтобы поддерживать целостность в течение установленного времени. Прочность клеевых соединений можно оценить с помощью испытаний на растяжение или на разрыв и на отслаивание. Материалы барьерных систем для стерилизации можно испытать на такие основные свойства, как предел прочности при растяжении, удлинение, прокол и сопротивление раздиранию, барьерные свойства и др. (см. 4.3).
М.2 Требование ИСО 11607-1 заключается в том, что испытание на стабильность должно выполняться на основе старения в реальном времени. Данные о стабильности на основе ускоренного старения обычно используются, пока не получат результаты при естественном старении. При подготовке образцов барьерных систем для испытания на стабильность необходимо оценить такое же число образцов, как для испытания при ускоренном старении, которые стерилизуют и помещают на хранение для старения в естественных условиях. Состаренные образцы часто испытывают через интервалы, более короткие, чем конечная дата, указанная на этикетке барьерной системы для стерилизации, особенно при оценивании новых материалов, когда данных о стабильности не имеется или они ограничены.
М.3 В стандарте ASTM F1980 дается ценное руководство, касающееся разработки условий ускоренного старения, и обсуждается важность выбора температур для старения, которые не превышают пределов, установленных для материалов барьерных систем для стерилизации. В документе также обсуждаются разделение изучения стабильности и испытаний эффективности упаковочной системы и дальнейшие пункты, исходя из того факта, что нет необходимости включать медицинские изделия в образцы барьерных систем для испытания на стабильность.
М.4 Понятно, что данные для критериев "пройдено/не пройдено" можно получить в испытаниях на ускоренное старение или старение в реальном времени. В то же время температуры ускоренного старения могут создать для материала и барьерной системы для стерилизации крайне сложные условия, которые не могут возникать в реальном мире, и таким образом создается ложное представление о видах отказов. При определении температур старения и критериев приемки необходимо проявлять большое терпение. Пользователь может поискать тенденции, указывающие, что материалы и клеевые соединения могут изменяться таким образом, что это со временем повлияет на целостность барьерной системы для стерилизации. Например, если тенденции заметно негативные, то материал может оказаться непригодным для использования. Решение об использовании выбранных материалов и барьерной системы для стерилизации основано на уровне риска и критичности характеристики по отношению к функции барьерной системы для стерилизации и упаковочной системы в процессе обращения, распределения и хранения и должно быть документально оформлено в обосновании.
М.5 ИСО 11607-1 совершенно четко разделяет испытания стабильности барьерной системы для стерилизации и испытания эффективности упаковочной системы и считает их отдельными разделами. Данный стандарт не запрещает пользователю объединить эти испытания, но при этом нереальные напряжения оказываются на образцы, что может привести к отказам, не происходящим при нормальном хранении и распределении. Существует несколько причин, по которым не следует объединять испытания стабильности и испытания эффективности упаковочной системы:
a) ИСО 11607-1 считает нарушение стерильности скорее связанным с событием, а не со временем. Такие события происходят при обращении, хранении и распределении медицинских изделий и обычно являются разрушительными по характеру.
b)
Объединение испытаний стабильности и
испытаний расчетных характеристик
может создать для упаковочных систем
нереальные экстремальные условия и
избыточные напряжения, не возникающие
в нормальных условиях распределения.
Например, ускоренное старение зачастую
воздействует на барьерные системы для
стерилизации постоянно повышенными
температурами (
c) Если отказ произойдет во время эксплуатационных испытаний состаренных упаковочных систем или барьерных систем для стерилизации, трудно или даже невозможно определить основную причину. Случился ли отказ за счет старения (времени) или это было проблемой расчетной эффективности упаковки (событие)? Приложение N (справочное)
Использование Интернета. Руководство для промышленных предприятий и медицинских учреждений Интернет стал полезным инструментом поиска информации по медицинским изделиям и соответствующим профессионалам. Поскольку адреса ссылок постоянно меняются, наилучшим вариантом является использование информационно-поисковой системы. Обычно поиск "регламенты по медицинским изделиям в (стране)" дает множество ссылок. Часто имеются указания адресов ссылок с переводами регламентов на других языках.
Приложение О (справочное)
Валидация метода испытания. Руководство для промышленных предприятий О.1 ИСО 11607-1:2006 и ИСО 11607-2:2006, раздел 4, требуют валидации всех методов испытания. Валидацию метода испытания интерпретируют разными путями. В приложении Q дано руководство по валидации метода испытания.
О.2 Методы испытания, которые подвергались официальным межлабораторным испытаниям [ILS, также известные как круговые (межлабораторные) исследования] являются предпочтительными, поскольку ILS всегда обеспечит пользователя заявлением, устанавливающим повторяемость (сходимость) и воспроизводимость метода испытания. Повторяемость (сходимость) является мерой вариации в пределах одной лаборатории и зависит от нескольких переменных, включая операторов, оборудование, изменения в зависимости от времени и т.д. Воспроизводимость является мерой вариаций между лабораториями. В большинстве примеров ILS также обеспечит пользователя показателем чувствительности метода испытания, которая является мерой пределов метода испытаний. ILS может также обеспечить показатель корректности метода испытаний. Все указывает на то, что метод испытаний может быть валидирован, однако важно отметить, что валидацию не производят в новой лаборатории без дополнительных мер.
О.3 При утверждении метода ILS в лаборатории необходимо принять меры для демонстрации, что этот метод работает так же, как работал при выполнении ILS. Обычно в отчете по ILS используются пробы различных материалов, на которых выполняются измерения в диапазоне результатов исследуемого метода испытания. Тогда как эти пробы обычно не идентифицируются в ILS, зачастую специалисты могут определить источник этих проб. Поэтому можно выполнить ограниченное внутреннее исследование для определения повторяемости в пределах вашей лаборатории. Такое исследование может принять во внимание такие факторы, как разные операторы или разное оборудование и т.п. Результаты такой валидации необходимо документировать (ИСО 11607-1:2006, подпункт 4.4.1). Критерий приемки будет выполнен, если внутренняя повторяемость будет равна или лучше ILS-воспроизводимости (ИСО 11607-1:2006, подпункт 4.4.2).
О.4 Нет необходимости демонстрировать, что чувствительность метода испытания одинакова с чувствительностью, определенной в ходе ILS. Достаточно будет документального подтверждения в обосновании, что пределы чувствительности в вашей лаборатории не выходят за рамки диапазона ILS (являются его подмножеством). Например, если лаборатория выполняет испытание материалов под гидростатическим давлением только в диапазоне от 20 до 50, то нет необходимости в валидации метода для значений ниже 15 и выше 60. В то же время это ограничение необходимо отметить, и если пробу испытывают выше или ниже установленных пределов, метод испытания подлежит валидации в новом диапазоне.
О.5 Имеется множество приемлемых методов испытаний, которые не проходили ILS. Эти методы могут быть описаны в научной литературе, национальных стандартах или разрабатываться в лаборатории. Наиболее важные вопросы, относящиеся к таким испытаниям: демонстрация, что при испытании реально измеряется то свойство, которое требовалось измерить; определение чувствительности и точности достаточно, чтобы измерить предполагаемое свойство в установленном диапазоне значений; определение повторяемости метода испытания. Это можно определить с помощью научных исследований путем тщательно спланированных экспериментов. И снова необходимо документально оформить результаты этих экспериментов (ИСО 11607-1:2006, подпункт 4.4.1).
О.6 В заключение следует сказать, что валидация методов испытания в лаборатории требует демонстрации путем проведения экспериментов, которые выполняются рассматриваемым методом, и подтверждения повторяемости в пределах данной лаборатории. Без такой валидации пользователь не сможет определить, приемлемые данные он собрал или нет. Приложение Р (справочное)
Использование подрядчиков для упаковывания. Руководство для промышленных предприятий и медицинских учреждений Р.1 Общие положения Подрядчики, производящие упаковывание, которых иногда называют договорными производителями или сторонними производителями, являются поставщиками упакованных медицинских изделий, готовых к стерилизации или уже стерилизованных. Эти производители предоставляют услуги компаниям медицинского оборудования в тех случаях, когда требуется дополнительная экспертиза, возможности или помещения для упаковывания медицинских изделий или когда компания сама желает отдать на сторону упаковывание по экономическим причинам.
Р.2 Функции, выполняемые сторонними упаковщиками Подрядчик может выполнять любую функцию или любую комбинацию из следующих функций:
a) проектирование, разработка и валидация полной конечной упаковочной системы;
b) упаковывание предоставленного медицинского изделия в барьерную систему для стерилизации, дополнительную защитную упаковку и/или полную упаковочную систему;
c) закупка материалов и компонентов по спецификации подрядчика или изготовителя медицинского изделия;
d) финишная стерилизация или стерилизация по субподряду упакованного медицинского изделия.
Р.3 Ответственность
Подрядчики должны работать в соответствии с Правилами организации производства и контроля качества (cGMPs) и требованиями регулирующих систем и систем качества, включая требования ИСО 11607-1 и ИСО 11607-2, как любой изготовитель медицинских изделий.
Изготовители медицинских изделий в качестве заказчика должны обеспечить соответствие подрядчика тем же условиям, как если бы они сами производили упакованные медицинские изделия. Сюда входят контроль проектирования, системы качества, упаковочные системы и валидация процессов, а также валидация стерилизации в зависимости от рассматриваемого случая. Главная ответственность и обязанности лежат на изготовителе медицинских изделий, имеющем разрешение контрольно-надзорных органов. Приложение Q (справочное)
Руководство по установлению параметров процесса. Руководство для промышленных предприятий Q.1 Общие положения Приложение Q применяется к компаниям-производителям предварительно сформированных барьерных систем для стерилизации и барьерных систем для стерилизации.
Критические параметры процесса, включая диапазоны и допуски, необходимы для обеспечения удовлетворения продуктом определенных требований при всех предполагаемых условиях производства. Эти параметры следует установить, используя статистически общезначимые методы. Примеры инструментов, которые можно использовать, включают:
- FMEA (анализ видов отказов и их последствий);
- DOE (планирование эксперимента);
- анализ кривой термосклеивания;
- визуальные признаки.
Q.2 Пример. Формирование и укупоривание лотка Q.2.1 FMEA (Анализ видов отказов и их последствий)
Анализ видов отказов и их последствий является систематическим методом изучения отказов. Его можно использовать для разработки продукции и контроля процессов. Он определяет серьезность и вероятность видов потенциальных отказов, которые обычно идентифицируют на основе предыдущего опыта в отношении аналогичных продуктов и процессов. В данном случае (разработка продукции) анализ используется для установления параметров процесса для оборудования на каждой стадии изготовления, загрузки (медицинского изделия в упаковку), склеивания (СБС) и процесса упаковывания, тогда как в приложении К описаны инструменты анализа риска.
Процедура анализа включает следующие стадии:
- идентификация, какие дефекты станут причиной браковки продукции (вид отказа);
- установление причины отказа и какая вероятность его возникновения;
- установление последствий каждого вида отказа;
- оценка по степени тяжести, частоте возникновения и легкости обнаружения каждого вида отказа;
- идентификация имеющихся видов контроля и вероятность обнаружения отказа;
- расчет категории приоритета уровня риска (RPN=КПУР) для каждого вида отказа по формуле
КПУР=Номер
уровня степени тяжести - рекомендованные действия по снижению КПУР.
Пример анализа видов отказов и их последствий приведен в таблице Q.1.
Таблица Q.1 - Пример
Q.2.2 Планирование эксперимента (DOE)
Планирование эксперимента используют для создания окна оптимальных параметров процесса. Иными словами, чтобы идентифицировать условия процесса, которые обеспечат постоянное производство продукции хорошего качества. Чем более подробные данные получены на этом этапе, тем легче осуществлять контроль процесса.
Формирование лотка и последующее термосклеивание крышки требуют учета температуры, давления и времени задержки (продолжительность термосклеивания). В обоих случаях необходимо идентифицировать диапазон условий процесса, которые будут иметь минимальное влияние на результирующую барьерную систему для стерилизации.
Например, условия процесса, необходимые для обеспечения приемлемой прочности клеевого соединения при термосклеивании с крышкой, должны:
- быть достаточно удалены от условий, которые приведут к отказу клеевого соединения;
- производить клеевое соединение хорошего качества;
- демонстрировать минимальную изменчивость прочности клеевого соединения.
Можно проводить эксперименты различного уровня - от простого, линейного скрининг-эксперимента, определяющего относительное влияние различных параметров на результирующее клеевое соединение, до высокой степени сложности, дробного факторного эксперимента (квадратичной модели). Зачастую простой линейный эксперимент проводят для подтверждения значимости параметров с последующим более сложным исследованием по главным точкам, чтобы получить хорошую математическую модель процесса, хорошо согласующуюся с данными. Часто обнаруживается, что температура является наиболее важной переменной, затем идет время и, наконец, давление редко бывает значимым на большом интервале.
Для установления оптимальных условий термосклеивания используют следующие инструменты:
- анализ кривой термосклеивания;
- визуальную оценку клеевых соединений;
- комбинацию анализа кривой термосклеивания и визуальной оценки;
- определение возможности процесса;
- целостность клеевого соединения;
- качество клеевого соединения (визуальную оценку).
Q.2.3 Анализ кривой термосклеивания (Оценка категории процесса)
Эта процедура включает оценивание, как матрица температуры, давления и продолжительности склеивания (паузы) влияет на прочность клеевого соединения. Кривые, построенные для определения значений различных параметров, обычно показывают, что переменное давление и время паузы имеют меньшее влияние на прочность клеевого соединения, поэтому эти параметры держат постоянными, а температуру меняют. Затем устанавливают предельные значения параметров процесса на интервале, где прочность клеевого соединения удовлетворяет техническим условиям. Барьерные системы для стерилизации с клеевыми соединениями, прочность которых выходит за допустимые пределы, должны сохранять целостность упаковки, хотя клеевые соединения могут показать небольшие визуальные дефекты (см. рисунок Q.1).
Обозначения:
X - температура;
Y - прочность клеевого соединения;
1 - предлагаемые пределы для процесса (диапазон проведения процесса)
Рисунок Q.1 - Кривая термосклеивания для оптимальных параметров процесса Q.2.4 Визуальные* метод оценки термосклеивания в баллах
Клеевые соединения оценивают по визуальным дефектам в обоих концах диапазона проведения процесса. Более высокие значения указывают на лучшее качество. Например:
а) Нижний конец диапазона склеивания
b) Верхний конец диапазона склеивания
Q.2.5 Комбинирование анализа кривой термосклеивания и визуальной оценки в баллах
Результаты, полученные от анализа термосклеенных соединений, можно объединить с результатами, полученными методом визуальной оценки в баллах, чтобы получить рисунок Q.2.
Обозначения:
X - температура;
1 - предлагаемые пределы для процесса;
2 - предложенные пределы спецификации
Рисунок Q.2 - Прочность и визуальное качество клеевого соединения в зависимости от температуры Q.2.6 Определение возможности процесса
Целью
валидации процесса является демонстрация
проведения процесса под статистическим
контролем и постоянного производства
продукции, соответствующей спецификации.
Наилучшей практикой является вычисление
возможности процесса
Если процесс центрированный, то используют формулу
где
USL - верхний заданный предел (по спецификации);
LSL - нижний заданный предел (по спецификации);
Если процесс нецентрированный, то используют формулу
где CSL - ближайший заданный предел; X - среднее процесса.
Руководящие
указания для значений
Таблица Q.2 - Пример значений
Чтобы
максимизировать
Если
провели исследование и не получили
минимальное значение
Следует использовать большое количество партий материалов - достаточное для обеспечения репрезентативного вида при ожидаемой вариации, чтобы проверить устойчивость развития процесса, - прежде чем приступить к более официальной деятельности по валидации. Приложение R (справочное)
Расследование (причин) отказа. Руководство для промышленных предприятий и медицинских учреждений R.1 Оценивание отказа R.1.1 Если в ходе валидации были обнаружены дефекты в предлагаемых упаковочных материалах или системах, существует несколько подходов, которые можно использовать для решения проблемы. Большинство из них включает анализ дефектов для определения источников или вид отказа. Для проведения такого анализа используют следующие инструменты:
a) микроскопический анализ;
b) полимерный анализ;
c) ручные манипуляции.
R.1.2 Если подход оказался неплодотворным, можно применить несколько подходов к решению проблем, чтобы определить коренную причину и, наконец, разработать план корректирующих действий, чтобы обеспечить решение возникшей проблемы.
R.2 Определение источника дефекта
R.2.1 С точки зрения анализа дефекта, вначале обычно определяют, чем вызвана проблема. Дефекты могут быть образованы за счет пяти основных источников:
- медицинское изделие;
- процесс;
- упаковочная система;
- человеческий фактор;
- окружающая среда.
R.2.2 Дефекты, причиненные медицинским изделием, можно отнести за счет массы или остроты медицинского изделия. Дефектная барьерная система для стерилизации и медицинское изделие следует собрать заново, следя за тем, чтобы уложить его таким же образом, чтобы можно было определить любую зависимость возникновения дефекта от формы или определить износ. Важно заново собрать полную конфигурацию упаковочной системы, включая барьерную систему для стерилизации и защитную упаковку. Зачастую отдельно барьерная система для стерилизации или отдельно упаковочная система четко не укажет на источник дефекта, но при разборке стопки упакованных медицинских изделий источник можно идентифицировать визуально.
R.2.3 Дефекты, причиненные в процессе, связаны с оборудованием - включая неадекватное техобслуживание оборудования. Чрезмерное колебание ключевых параметров процесса можно рассмотреть на стадии IQ валидации, но это нельзя считать возможными основными причинами. Необходимо выяснить наличие острых заусенцев на упаковочном оборудовании, обследовать конвейеры с выступающими шпильками и скобками, изношенные прокладки и несоответствующий ремонт оборудования как возможные основные причины. Дефекты, полученные от оборудования, часто неоднократно заявляют о себе, что составляет определенную часть процесса. Важно проследить барьерную систему для стерилизации или упаковочную систему с дефектом в обратном направлении до конкретного места процесса упаковывания. Какую вмятину нанесло медицинское изделие, какой канал получился при упаковывании, с какой стороны машины - все это важные вопросы. Посредством физического переноса дефектной барьерной системы для стерилизации или упаковочной системы обратно в упаковочный процесс, заново отслеживая стадии производства, можно открыть важные взаимосвязи.
R.2.4 Дефекты, которые не прослеживаются до медицинского изделия или процесса, можно отнести к упаковочной системе. Необходимо обследовать материалы конструкции, чтобы определить, соответствует ли выбранный материал требованиям к проколу, изгибным трещинам, абразивному истиранию или каким-либо иным характеристикам (см. приложение А). Необходимо изучить дефекты изготовления барьерной системы для стерилизации или упаковочной системы, чтобы определить, возник рассматриваемый дефект до поступления сырьевого материала на контроль, во время обработки на предприятии или после отгрузки с предприятия. Следует также оценить конструкцию упаковочной системы. Сюда должны входить значимые критерии проектирования, такие как размеры и конфигурация клеевого соединения, а также устройство защитной упаковки.
R.2.5 Можно рассмотреть проколы, возникающие при погрузке, разрезы или потертости, получаемые при обращении, и неправильные конфигурации загрузки как возможные области дальнейшего исследования. Человеческий фактор как причину появления дефектов - часто очень сложно распознать, поскольку иногда трудно получить нужную информацию. Важно расспрашивать работников, занятых в производстве упаковочных систем, о том, что в действительности происходило. Не менее важно определить, четко ли выполнялись стандартные процедуры и протоколы.
R.2.6 Отказы, возникающие в результате воздействия окружающей среды, могут иметь разные источники. Изменение воздушного потока вокруг оборудования, которое требует контроля температуры, иногда может вызвать перегрев или недостаточный нагрев деталей аппарата, заготовок и/или материалов. Например, воздушный кондиционер периодического цикла, расположенный вверху и направляющий поток воздуха на прижимную плиту для термосклеивания, может оказаться виртуальным виновником. В некоторых случаях чрезмерные колебания влажности или температуры в окружающей среде или продолжительное воздействие ультрафиолета может внести вклад в образование дефектов, таких как проблемы, связанные с адгезией типографской краски или этикетки, повышением хрупкости упаковочной системы или обесцвечиванием.
R.3 Химические или механические причины
R.3.1 При расследовании причины появления дефектов на барьерной системе для стерилизации или упаковочной системе важно постараться различить химические и механические причины.
R.3.2 Химические причины можно разбить на три категории:
a) химические изменения самого материала (например, ухудшение за счет возникновения поперечных сшивок или появления налета);
b) химическое взаимодействие между упаковочными материалами и медицинскими изделиями (например, вымывание пластификаторов или добавок из медицинского изделия или барьерной системы или из упаковки, наносящих ущерб другому);
c) химическое взаимодействие между защитной упаковкой и барьерными системами для стерилизации (например, пожелтение барьерной системы за счет переноса антиоксидантов из гофрированных материалов или поликристаллических оболочек). Химические причины являются результатом реакций или изменений молекулярной природы, например окисления или кристаллизации упаковочных материалов. Следует проверить добавки в материалах (например, компоненты термоплавких покрытий, добавки в бумагу, добавки против скольжения, антиадгезии, технологические добавки или загрязняющие вещества), чтобы подтвердить, что они не изменили упаковочную систему или медицинское изделие и не взаимодействовали с ними, что привело бы к возможному появлению дефекта.
R.3.3 Напротив, механические отказы, такие как образование трещин в изгибе, проколы, истирание и/или разрезы/срезы, необходимо отличать от химических отказов. Обсуждение с поставщиками часто бывает важным шагом в этой точке для определения возможных исторических механизмов отказов. Зачастую неофициальные воспоминания некоторых экспертов на предприятиях могут привести к плодотворному решению проблемы.
R.3.4 Важно заново собрать упаковочную систему целиком, подобно тому, как это сделал бы эксперт-криминалист. Основные формы медицинского изделия и упаковочной системы следует вернуть к первоначальной ориентации. Попадание медицинского изделия в клеевые соединения, наложение барьерных систем одна на другую, давление массы медицинских изделий на нижнее изделие в стопке - все это возможные виды отказов, которые наилучшим образом определяются при исследовании всех обстоятельств. Часто удаление одной картонки из гофрированной тары может привести к пониманию причины отказа. Это можно сделать в сочетании с вибрационным испытанием или испытанием на падение. Видеоанализ с высокоскоростной съемкой поможет увидеть образование дефекта в развитии.
R.4 Другие инструменты
R.4.1 Микроскоп, независимо от того стереомикроскоп, поляризационный микроскоп или микроскоп для высокотемпературных исследований, является очень важным инструментом, помогающим систематизировать потенциальные причины отказов. Отрегулированный стереомикроскоп, который предоставляет трехмерный вид, может определить, внутри или вне барьерной системы для стерилизации возникли дефекты, что позволит продвинуться в поиске виновника. Поляризационный микроскоп вскрывает невидимые напряжения в пластиковой пленке. Эти напряжения можно использовать для определения, насколько прокол растянул пленку и продавил ее в определенном направлении. Это поможет различить такие виды отказов, как трещина при изгибе, истирание и прокол. Наконец, микроскоп для высокотемпературных исследований дает возможность расплавить полимерную пленку под микроскопом. Внедренные частицы можно нагреть и определить, являются ли они гелем или посторонним загрязнителем посредством наблюдения, при какой температуре эта частица расплавляется. Дефекты размером меньше разрешения оптического микроскопа (менее 5 мк) можно оценить, используя сканирующий электронный микроскоп (SEM=СЭМ).
R.4.2 Имеется большое количество инструментов для исследования полимеров, которые особенно полезны для определения изменения пластмасс:
a) DSC=ДСК: Дифференциальные сканирующие калориметры или ДСК могут обеспечить данными о точках размягчения и в дополнение к помощи в определении, какие материалы присутствуют, определить их точки плавления и открыть различия в кристалличности.
b) FTIR=ИС-НПВО: Инфракрасная спектрометрия может определить, какие молекулярные функциональные группы имеются и, исходя из этого, дать сведения о составе материала. Сканы нарушенного полного внутреннего отражения (A.T.R.) поверхности помогут определить присутствие налета или других контаминантов, которые могут повлиять на прочность клеевого соединения.
c) GC=ГХ: Газовая хроматография может предоставить данные, касающиеся остаточных растворителей, мономеров и пластификаторов.
d) Существует множество других физических методов испытания, которые могут оказаться полезными в конкретных обстоятельствах, включая измерение массы, испытания на абразивный износ и истирание, определение плотности, размеров, усталости и растрескивания при изгибе, измерение прочности, жесткостных свойств, адгезии и проницаемости. Наиболее современные лабораторные испытания, которые могут помочь, включают высокоэффективную жидкостную хроматографию (HPLC=ВЭЖХ), гельпроникающую (ситовую) хроматографию (GPC=ГПХ), атомно-абсорбционную спектроскопию (AAS=ААС), атомно-эмиссионную спектроскопию (AES=АЭС), масс-спектрометрию (MS=МС), анализ с помощью Оже-микрозонда, электронную спектроскопию для химического анализа (ESCA=ЭСХА) и просвечивающую электронную спектроскопию (ТЕМ=ПЭМ). Поставщики сырьевых материалов могут помочь в выборе подходящих методов испытания.
R.4.3 Один из последних "методов испытания", который оказался полезным, - это попытка воссоздать дефект посредством простой ручной манипуляции. Этот класс испытаний предполагает применение избыточного усилия в попытке воссоздания вида дефекта. Часто аналитические данные по прочности материалов, проектам упаковочных систем и взаимодействиям можно получить только при непосредственном наблюдении сил и реакций упаковки. Испытания простой манипуляцией могут показать направления, в которых надо двигаться.
R.5 Подход к решению проблем
Если лабораторные методы исследования не вскрывают источник проблемы, может помочь дополнительное расследование с использованием блок-схем процессов, аудитов производственной линии, планирования экспериментов, диаграмм Исикавы, а также перечня всех возможных переменных. Возвращение к документу FMEA (см. приложение К) для анализа возможных источников ошибки также является хорошим подходом. Кроме того, тщательный анализ, что могло измениться или в чем отличие от других прошедших валидацию упаковочных систем, может дать направление для следующего шага к решению проблемы. Все этапы точного и прецизионного описания проблемы, сбор имеющихся данных и идентификация, испытание возможных коренных причин с последующим определением и верификацией решения являются критичными. Итак, важно провести подтверждающее исследование с воссозданием проблемы, выполнением корректирующего действия, а затем испытаний для устранения проблемы. Приложение S (справочное)
Процесс изготовления упаковки и проектирование упаковочной системы. Оценка осуществимости. Руководство для промышленных предприятий S.1 Оценка осуществимости начального и полномасштабного производственного процесса упаковывания Оценивают осуществимость начального и полномасштабного производственного процесса упаковывания для типа упаковочной системы, выбранного в 4.4.2.1 и 4.4.2.2. Типичные проблемы описаны ниже. На данный момент можно также использовать подрядчика для упаковывания. Для руководства по использованию стороннего упаковщика см. приложение Р.
S.1.1 Планируемый объем В первую очередь за счет стоимости оборудования изделия меньшего объема обычно упаковывают в предварительно сформированные барьерные системы для стерилизации, а медицинские изделия очень большого объема часто упаковывают с помощью процесса заклеивания заполненной формы. Исключение составляют случаи, если оборудование предназначено для склеивания заполненных форм. Если существует оборудование для склеивания, рассчитанное на большой объем изделия, см. приложение Q.
S.1.2 Наличие оборудования/персонала Если уже существует упаковочная линия, оценивают ее возможности в отношении планируемого объема изделия.
S.1.3 Руководство по основным средствам Если имеется упаковочная линия, рассчитанная на планируемый объем медицинского изделия, рассчитывают затраты на обучение персонала, закупку новых инструментов и валидацию этой упаковочной системы. Если требуется новая линия, вычисляют затраты на новое оборудование с учетом дополнительных потребностей (например, пространство, электричество, сжатый воздух), персонала и его подготовки, а также на валидацию упаковочной линии и данной конкретной упаковочной системы.
S.1.4 Общая стоимость упаковочной системы Иногда полезно сначала определить процесс (см. 4.5.2). Суммируют:
a) затраты на компоненты, включая предполагаемые отходы, образующиеся в ходе процесса склеивания;
b) затраты на производство/склеивание, включая начальное оборудование и текущие (эксплуатационные) расходы;
c) прямые затраты на оплату труда;
d) затраты на обеспечение качества/инженерный штат и другой обслуживающий персонал;
e) затраты на дополнительное этикетирование или маркировку;
f) затраты на защитную упаковку, которая требуется для определенного типа барьерной системы для стерилизации, распределенные по единицам на вторичную упаковку; или затраты на дополнительное упаковывание;
g) затраты на стерилизацию на барьерную систему для стерилизации.
Считают, что различные объемы или конфигурации упаковочных систем могут соответствовать различным степеням загрузки в процессе стерилизации.
S.2 Оценка осуществимости проекта упаковочной системы Оценивают осуществимость выбранной в 4.4 упаковочной системы. Типичные проблемы перечислены ниже.
Примечание - Осуществимость не входит в требования ИСО 11607-1 или ИСО 11607-2. Данный раздел используется для оценки осуществимости упаковочной системы.
S.2.1 Оценка осуществимости проекта упаковочной системы S.2.1.1 Это техническая оценка, в ходе которой вся упаковочная система в целом (возможно, только опытный образец на этом этапе) подвергается физическим и климатическим напряжениям и анализу испытаний после приложения напряжений. Результаты этих испытаний определяют, стоит ли осуществлять представленный проект.
S.2.1.2 В испытаниях после приложения напряжений обычно оценивают:
a) состояние упаковки, этикеток и маркировки защитной упаковки;
b) сохранение и защиту медицинского изделия со стороны барьерной системы для стерилизации, в которой изделие содержится, от физических повреждений;
c) возможные физические взаимодействия между барьерной системой и ее содержимым;
d) сохранение барьерной стерильной системой своего микробного барьера.
S.2.1.3 Поскольку этот этап зачастую не является полномасштабной валидацией, см. руководство в приложении I о разработке протокола валидации конечной (стерильной) упаковочной системы.
S.2.2 План исследования возможности применения спроектированной упаковочной системы S.2.2.1 Используют документированный план, разработанный на основе прошедших валидацию методов испытания, технических условий, руководств и практического опыта (ИСО 11607-1:2006, подпункт 6.3.2). См. приложение А для дополнительной информации по методам испытаний.
S.2.2.2 План испытаний включает критерии "пройдено/не пройдено".
S.2.2.3 Испытания барьерной системы для стерилизации проводят на образцах, отобранных с учетом наихудших допустимых вариантов, предусмотренных в 4.6.3 (ИСО 11607-1:2006, подпункт 6.3.4).
S.2.2.4 Образцы подвергают физическим или динамическим и климатическим напряжениям, которые имитируют ожидаемые напряжения в условиях распределения, обращения и хранения (ИСО 11607-1:2006, подпункт 6.3.5).
S.2.3 Определение осуществимости методом наихудшего случая Примечание - Дополнительное руководство по определению методом наихудшего случая см. в приложении Н.
Для подтверждения достоверности оценки осуществимости определяют условия наихудшего допустимого варианта или условия, которые в данном месте считаются наихудшим вариантом для ряда факторов, относящихся к упаковочной системе. Сюда входят (но этим не ограничивается):
a) производство барьерной системы для стерилизации (параметры склеивания и т.д.);
b) стерилизация (параметры, число циклов и т.п.). Не требуется для образцов, которые стерилизуют для первоначальной оценки осуществимости;
c) конфигурация упаковочной системы. Здесь требуется понимание, как медицинское изделие будет продаваться, какая будет единица продажи и единица испытания. Одно и то же медицинское изделие может быть продано в различных конфигурациях упаковочной системы. Например, его можно продать как отдельное медицинское изделие в барьерной системе для стерилизации с защитной упаковкой в коробке с необходимыми этикетками и маркировкой. Его можно также продать в коробке на 12 шт., 12 барьерных систем с защитной упаковкой в отдельной коробке с необходимыми этикетками и маркировкой. Его можно также продать как 50 барьерных систем с защитной упаковкой в отдельной коробке со всеми необходимыми этикетками и маркировкой. Еще могут быть единицы для продажи размера палета;
d) конфигурация отгрузки. Необходимо понимать, как упаковочная система будет отправляться заказчику (потребителю) и будет ли она переупаковываться во время заказанного потребителем процесса заполнения;
e) условия распределения. Здесь требуется понимание, как упаковочная система будет отправляться заказчику (потребителю).
S.2.4 Статус упаковочной системы "прошла/не прошла" испытания
S.2.4.1 После завершения создания напряжений для упаковочной системы необходимо определить выдержала она их или не выдержала.
S.2.4.2 Упаковочная система прошла испытания осуществимости, если удовлетворяет всем критериям "пройдено/не пройдено", установленным в плане проверки осуществимости спроектированной упаковочной системы. Таким образом создается уверенность, что спроектированная система будет работать и функционировать по назначению. Начинают подготовку к валидации упаковочной системы, обычно изготовленной с помощью прошедшего валидацию технологического процесса (см. 4.7).
S.2.4.3 Если упаковочная система не выполняет все критерии, установленные в плане, то определяют виды отказов и расследуют их причины. Выполняют корректирующие действия. Они могут включать пересмотр концепции упаковочной системы и повторное определение осуществимости. Руководство по определению видов отказов и соответствующим корректирующим действиям см. в приложении R.
Библиография
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||