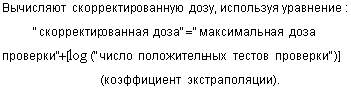|
| Безопасность технологии |
 |
| WHO – Всемирная ассоциация здравоохранения |
 |
| UE SCF – Научный комитет по проблемам продовольствия |
 |
| MAFF – Министерство сельского хозяйства, лесных угодий и рыбного промысла Японии |
 |
| EFSA – Европейское агентство по безопасности продуктов питания |
 |
| US FDA – Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США |
|
ГОСТ ISO 11137-2-2011
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
СТЕРИЛИЗАЦИЯ МЕДИЦИНСКОЙ ПРОДУКЦИИ. РАДИАЦИОННАЯ СТЕРИЛИЗАЦИЯ
Часть 2
Установление стерилизующей дозы
Sterilization of health care products. Radiation. Part 2. Establishing the sterilization dose МКС 11.080.01 Дата введения 2013-01-01
Предисловие Цели, основные принципы и порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский институт стандартизации и сертификации в машиностроении" (ВНИИНМАШ)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол N 40 от 29 ноября 2011 г.)
За принятие проголосовали:
4 Приказом Федерального агентства по техническому регулированию и метрологии от 13 декабря 2011 г. N 1279-ст межгосударственный стандарт ГОСТ ISO 11137-2-2011 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2013 г.
5 Настоящий стандарт идентичен международному стандарту ISO 11137-2:2006* Sterilization of health care products - Radiation - Part 2: Establishing the sterilization dose (Стерилизация медицинской продукции. Радиационная стерилизация. Часть 2. Установление стерилизующей дозы).
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам приведены в дополнительном приложении ДА.
Степень соответствия - идентичная (IDT).
Стандарт подготовлен на основе применения ГОСТ Р ИСО 11137-2-2008
6 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта публикуется в ежемесячно издаваемом указателе "Национальные стандарты".
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра или отмены настоящего стандарта соответствующая информация будет опубликована в ежемесячно издаваемом информационном указателе "Национальные стандарты"
Введение Серия стандартов ISO 11137 под общим названием "Стерилизация медицинской продукции. Радиационная стерилизация" состоит из следующих стандартов:
- Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий;
- Часть 2. Установление стерилизующей дозы;
- Часть 3. Руководство по вопросам дозиметрии.
Настоящее первое издание указанной серии стандартов отменяет действие стандарта ISO 11137-2000 и заменяет его.
1 Область применения
Настоящий
стандарт устанавливает методы определения
дозы, необходимой для удовлетворения
установленного требования к стерильности,
и методы для обоснования значений 25 или
15 кГр как стерилизующей дозы для
достижения уровня обеспечения стерильности
(
В настоящем стандарте определяются серии продукции/продуктов для установления дозы и проверки дозы.
2 Нормативные ссылки Следующие ссылочные нормативные документы* являются обязательными при применении данного документа. Для датированных ссылок применяется только цитированное издание документа. Для недатированных ссылок необходимо использовать самое последнее издание нормативного ссылочного документа (включая любые изменения).
ISO 11137-1:2006 Sterilization of health care products - Radiation - Part 1: Requirements for development, validation and routine control of a sterilization process for medical devices (Стерилизация медицинской продукции. Радиационная стерилизация. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий)
ISO 11737-1:2003 Sterilization of medical devices - Microbiological methods - Part 1: Determination of a population of microorganisms on products (Стерилизация медицинских изделий. Микробиологические методы. Часть 1. Оценка популяции микроорганизмов на продукции)
ISO 11737-2:2003 Sterilisation of medical devices. Microbiological methods. Part 2. Tests of sterility performed in the validation of a sterilization process (Стерилизация медицинских изделий. Микробиологические методы. Часть 2. Испытания на стерильность, проводимые при валидации процессов стерилизации)
ISO 13485:2003 Medical devices Quality management systems - Requirements for regulatory purposes (Изделия медицинские. Системы менеджмента качества. Системные требования для целей регулирования)
3 Термины, определения и обозначения
3.1 Термины и определения В настоящем стандарте применены термины по ISO 11137-1, а также следующие термины с соответствующими определениями:
3.1.1 партия (batch): Определенное количество изделий, являющихся или предполагаемых единообразными по характеру и качеству, которые были изготовлены в определенном цикле производства.
[ISO/TS 11139:2006]
3.1.2 бионагрузка (bioburden): Популяция жизнеспособных организмов на/в продукции и/или системе защиты стерильности.
[ISO/TS 11139:2006]
3.1.3 ложноположительный результат (false positive): Результат испытания, интерпретируемый как появление роста числа микроорганизмов, принадлежащих испытуемой продукции или ее части, в то время как этот рост обусловлен внешним микробным загрязнением или помутнением, вызванным взаимодействием между продукцией или ее частями и испытательной средой.
3.1.4 доля положительных результатов (fraction positive): Коэффициент, в котором числитель показывает число положительных испытаний, а знаменатель - число проведенных испытаний.
3.1.5 возрастающая доза (incremental dose): Возрастающий ряд значений дозы, при которых облучается определенное количество продукции или ее частей, при определении и подтверждении стерилизующей дозы по методу 2В.
3.1.6 отрицательный результат испытания на стерильность (отрицательный тест) (negative test of sterility): Результат испытания, который не показывает никакого микробного роста в продукции или ее части, подвергнутых тесту на стерильность.
3.1.7 упаковочный комплект (packaging system): Комбинация системы защиты стерильности и защитной упаковки.
[ISO/TS 11139:2006]
3.1.8 положительный результат испытания на стерильность (положительный тест) (positive test of sterility): Результат испытания, который показывает микробный рост из продукции или ее части, подвергнутых тесту на стерильность.
3.1.9
часть
продукции для испытания (
3.1.10 система защиты стерильности (sterile barrier system): Минимальная упаковка, которая предотвращает проникновение микроорганизмов и обеспечивает асептическое представление продукции в месте использования.
3.1.11
уровень
обеспечения стерильности (
[ISO/TS 11139:2006]
Примечание
- Данный термин имеет количественное
значение, обычно 10
3.1.12 проверка стерилизующей дозы (sterilization dose audit): Процедура, предпринятая для подтверждения соответствия установленной стерилизующей дозы.
3.1.13
верификационная
доза
(verification dose): Значение дозы, обеспечивающее
3.2 Обозначения В настоящем стандарте применены следующие обозначения:
3.2.1
3.2.2
3.2.3
3.2.4
Примечание
- Обычно это среднее из значений
3.2.5
3.2.6
3.2.7
3.2.8
значение
[ISO/TS 11139:2006]
Примечание
- В настоящем документе
3.2.9
первая
дробная положительная доза
(first fraction positive dose)
3.2.10 первая дробная положительная доза (First Fraction Positive dose)
3.2.11 первая доза без положительных результатов (First No Positive dose)
3.2.12
3.2.13
4 Определение и техническое обслуживание серии продукции для установления, обоснования и проверки стерилизующей дозы
4.1 Общие вопросы Установление стерилизующей дозы и проведение проверки стерилизующей дозы являются процедурами, которые составляют часть определения процесса (см. ISO 11137-1, раздел 8) и поддержания эффективности процесса (см. ISO 11137-1, раздел 12). Для этих процедур продукцию можно сгруппировать по сериям; определение серии продукции основано главным образом на числе и типах микроорганизмов, присутствующих на или в продукции (бионагрузка). Тип микроорганизма характеризуется его стойкостью к облучению. Такие параметры, как плотность и конфигурация продукта в пределах упаковочного комплекта, не учитываются при установлении серии продукции, потому что они не являются факторами, которые влияют на бионагрузку.
При использовании серии продукции для установления стерилизующей дозы и для проверки этой дозы важно знать о рисках, таких как уменьшение возможности обнаружения случайного изменения в пределах производственного процесса, которое влияет на эффективность стерилизации. Кроме того, при использовании единичного продукта для представления серии продукции можно не обнаружить изменений, которые происходят в других компонентах этой серии продукции. Оценка риска, связанного с уменьшением возможности обнаружения изменений в других компонентах серии продукции, а также разработка и реализация плана технического обслуживания серии продукции должны быть проведены перед испытаниями.
Примечание - См. ISO 14971 для руководящих указаний по менеджменту рисков.
4.2 Определение серийности продукции 4.2.1 Критерии для определения серийности продукции должны быть документированы. Продукцию оценивают по этим критериям, и рассматриваются сходные черты между потенциальными компонентами серии продукции. Рассмотрение включает все параметры, связанные с продукцией, которые влияют на бионагрузку, включая, но не ограничиваясь этим, к ним относятся:
a) природа и источники сырьевых материалов, включая влияние (если таковое имеется) сырьевых материалов, которые могли быть получены более чем из одного источника;
b) компоненты;
c) конструкция и размер продукции;
d) производственный процесс;
e) производственное оборудование;
f) производственная среда;
g) местонахождение производства.
Результат оценки и рассмотрения должен быть документирован (см. ISO 11137-1:2006, пункт 4.1.2).
4.2.2 Продукт только тогда включают в серию продукции, когда подтверждается, что относящиеся к нему параметры (см. 4.2.1) аналогичны и находятся под контролем.
4.2.3 Для того, чтобы продукт был введен в серию продукции, должно быть продемонстрировано, что бионагрузка включает аналогичное число и аналогичные типы микроорганизмов.
4.2.4 Включение продукта более чем из одного местонахождения производства в серию продукции должно быть специально обосновано и документировано (см. ISO 11137-1:2006, пункт 4.1.2). Должно быть рассмотрено влияние на бионагрузку:
а) географических и/или климатических различий между местонахождениями производства;
b) любых различий в управлении производственным процессом или окружающей средой;
c) источников сырьевых материалов и вспомогательных средств обработки (например, вода).
4.3 Обозначение продукта, представляющего серию продукции для проведения эксперимента с проверочной дозой или проверки стерилизующей дозы 4.3.1 Изделие для представления как серия продукции
4.3.1.1 Число и типы микроорганизмов на или в изделии должны применяться как основание для выбора изделия, которое будет представлять серию продукции.
4.3.1.2 Серия продукции должна быть представлена:
a) главным изделием (см. 4.3.2)
или
b) эквивалентным изделием (см. 4.3.3),
или
c) имитирующим изделием (см. 4.3.4).
4.3.1.3 Формальная документированная оценка предпринимается для решения, какой из трех потенциальных представительных продуктов в 4.3.1.2 является подходящим. В этой оценке рассматривают следующее:
a) число микроорганизмов, составляющих бионагрузку;
b) типы микроорганизмов, составляющих бионагрузку;
c) окружающая среда, в которой появляются микроорганизмы;
d) размер продукта;
e) число компонентов;
f) сложность продукта;
g) степень автоматизации производства;
h) производственная среда.
4.3.2 Главное изделие
Элемент серии продукции считается главным изделием только тогда, когда оценка (см. 4.3.1.3) показывает, что признак этого элемента выше всех других элементов серии продукции. В некоторых ситуациях может быть несколько элементов в пределах серии продукции, каждый из которых может считаться главным продуктом. В таких случаях каждый из этих элементов может быть выбран как главное изделие, чтобы представлять серию продукции согласно 4.3.3.
4.3.3 Эквивалентное изделие
Группа продуктов считается эквивалентной только в том случае, если оценка (см. 4.3.1.3) показывает, что для элементов группы требуется одинаковая стерилизующая доза. Выбор эквивалентного продукта для представления серии должен быть случайным или согласно запланированной схеме включения различных элементов серии продукции. Объем производства и наличие продуктов следует учитывать при выборе эквивалентного продукта для представления серии продукции.
4.3.4 Имитирующее изделие
Имитирующее изделие может представлять серию продукции только в том случае, если оно составляет аналогичную или более значительную проблему для процесса стерилизации, чем элементы серии продукции. Имитирующее изделие упаковывают таким же образом и с использованием таких же материалов, что и подлинный продукт.
Примечание - Имитирующее изделие не предназначено для клинического использования; его изготовляют только для установления или поддержания стерилизующей дозы.
Имитирующее изделие может быть:
a) изделием, аналогичным подлинному продукту по материалу и размеру и подвергаемым аналогичным производственным процессам (например, кусок материала, используемый для имплантатов, который проходит через весь производственный процесс);
b) комбинацией компонентов из продуктов в пределах серии продукции, которые, как правило, не комбинируются для использования (например, набор трубок, содержащий разнообразные фильтры, зажимы и задвижки, которые являются компонентами других продуктов в этой серии продукции).
4.4 Техническое обслуживание серии продукции 4.4.1 Периодическая экспертиза
Экспертиза должна проводиться с установленной частотой для гарантии, что серия продукции и продукты, используемые для представления каждой серии, остаются действительными. Ответственность за экспертизу продукта и/или процесса, которые могли повлиять на состав серии продукции, принадлежит компетентному персоналу. Такие проверки должны проводиться не меньше одного раза в год. Результат экспертизы должен быть документирован согласно ISO 11137-1:2006, пункт 4.1.2.
4.4.2 Модификация продукции и/или производственного процесса
Модификации продукции, связанные с сырьевыми материалами (природа и источник), компонентами или конструкцией продукции (включая размер), и/или модификации производственного процесса, связанные с оборудованием, окружающей средой или местонахождением, должны оцениваться посредством официальной документированной системы контроля изменений. Такие модификации могут изменять положения, на основе которых была определена серия продукции или сделан выбор продукта для представления серии. Значительные модификации могут потребовать определения новой серии продукции или выбора другого образца продукции.
4.4.3 Регистрация данных
Регистрационные данные о сериях продукции следует хранить в соответствии с ISO 11137-1:2006, пункт 4.1.2.
4.5 Действия в случае обнаружения несоответствия стерилизующей дозы для серии продукции При установлении или проведении проверки стерилизующей дозы в случае обнаружения несоответствия значения стерилизующей дозы следует считать, что это значение стерилизующей дозы не соответствует всем элементам данной серии продукции. Соответствующие действия должны применяться ко всем продуктам, содержащим данную серию.
5 Выбор и испытание продукции для установления и проверки стерилизующей дозы
5.1 Характеристика продукции 5.1.1 Продукция для стерилизации может состоять из:
a) индивидуального медицинского продукта в упаковочном комплекте;
b) набора компонентов в упаковочном комплекте, которые собирают в месте использования для составления медицинского продукта, вместе с аксессуарами для использования этого продукта в сборе;
c) нескольких медицинских продуктов в упаковочном комплекте;
d) набора, включающего разнообразные медицинские продукты, связанные с процедурами.
Единицы продукции для установления и обоснования дозы берутся согласно таблице 1.
Таблица 1 - Характеристика единиц продукции для установления и проверки стерилизующей дозы
5.1.2 Если продукт имеет требование стерильности для части продукта, то стерилизующая доза может быть установлена только на основе этой части.
Пример - Если на этикетке продукта имеется указание о стерильности только для канала протекания жидкости, то стерилизующая доза может быть установлена на основе определений бионагрузки и результатов испытаний, выполненных на этом канале.
5.2
Часть продукции для испытания (
5.2.1
Для испытания продукта со средней
бионагрузкой 1,0 или больше согласно
таблице 1 следует использовать, если
это практически осуществимо, продукт
целиком (
5.2.2
Для испытания продукта со средней
бионагрузкой 0,9 или меньше согласно
таблице 1 следует использовать продукт
целиком (
5.2.3
Если бионагрузка равномерно распределена
на или в продукте,
Величину
Таблица
2 - Примеры для вычисления
5.2.4
Приготовление и упаковка испытательных
частей продукции должны проводиться в
условиях, обеспечивающих минимизацию
изменений бионагрузки. Отбор
5.2.5
Адекватность выбранной
5.3 Метод отбора образцов 5.3.1 Продукт для установления или проверка стерилизующей дозы должен быть образцовым для продукции, подлежащей текущим процедурам и условиям обработки. Обычно каждый продукт, используемый для определения бионагрузки или для испытания на стерильность, следует брать из отдельного упаковочного комплекта.
5.3.2 Промежуток времени между отбором образцов продукции и определением бионагрузки должен соответствовать времени между завершением последнего производственного этапа и стерилизацией продукции. Единицы продукции можно отбирать из продуктов, отбракованных в ходе производственного процесса при условии, что они подвергались такой же обработке и в тех же условиях, что и остальные продукты.
5.4 Микробиологические испытания 5.4.1 Определения бионагрузки и испытания на стерильность должны проводиться по ISO 11737-1 и ISO 11737-2 соответственно.
Обычно для испытаний на стерильность в качестве питательной среды рекомендуется соево-казеиновый питательный бульон с температурой инкубации (30±2) °С и периодом инкубации 14 дней. В сомнительных случаях, когда эта среда и указанная температура не поддерживают рост присутствующих микроорганизмов, следует использовать другие питательные среды и другую температуру инкубации (например, [7], [10], [12]).
Всегда, если есть возможность, продукт следует облучать в его первичной форме и упаковке. Однако чтобы уменьшить возможность ложноположительных результатов испытания на стерильность, продукт можно разобрать и повторно упаковать до облучения. Манипуляции до облучения неприемлемы, если они изменяют величину бионагрузки или ее ответную реакцию на облучение (т.е. манипуляции, которые изменяют химическую среду вокруг микроорганизмов, обычно это потенциал кислорода). Материалы для повторной упаковки продуктов для облучения должны быть способны противостоять воздействующим дозам и последующим манипуляциям, тем самым минимизируя вероятность контаминации.
5.4.2 Определения бионагрузки проводят на продукте, который уже прошел процесс упаковки.
Примечание - Обычно достаточно выполнить определение бионагрузки на продукте после его извлечения из упаковочного комплекта и исключить упаковочный комплект из определения бионагрузки.
5.5 Облучение 5.5.1 Облучение продукции при установлении и проверке стерилизующей дозы проводят в облучателе, который прошел аттестацию установленного (АУО), действующего (АДО) и эксплуатируемого (АЭО) оборудований согласно ISO 11137-1. Для проведения эксперимента с проверочной дозой или с возрастающей дозой составляют карту поля доз для установления самой высокой и самой низкой дозы, полученных продуктом.
5.5.2 Измерения дозы и использование источников излучения должны соответствовать ISO 11137-1.
Примечание - См. ISO 11137-3 для указаний по дозиметрическим вопросам стерилизации облучением.
6 Методы установления дозы 6.1 Если стерилизующую дозу устанавливают по ISO 11137-1 [пункт 8.2.2, перечисление а)], характерная стерилизующая доза для данной продукции), то используют следующие методы:
a) метод 1 для нескольких и единичных партий (см. раздел 7);
b) метод 2А (см. 8.2);
c) метод 2В (см. 8.3);
d) метод, обеспечивающий такое же соответствие установленным требованиям к стерильности, как перечисления а), b) или с).
6.2 Если стерилизующую дозу устанавливают по ISO 11137-1:2006 [пункт 8.2.2, перечисление b)], то она должна быть обоснована одним из следующих методов:
a) для продукции со средней бионагрузкой в диапазоне от 0,1 до 1000 (включительно):
1)
метод
2)
метод 1 (см. раздел 7), при условии получения
стерилизующей дозы со значением
3)
метод 2 (см. раздел 8), при условии получения
стерилизующей дозы со значением
4)
метод, обеспечивающий такое же получение
максимального
b) для продукции со средней бионагрузкой в диапазоне от 0,1 до 1,5 (включительно):
1)
метод
2)
метод 1 (см. раздел 8), при условии получения
стерилизующей дозы со значением
3)
метод 2 (см. раздел 8), при условии получения
стерилизующей дозы со значением
4)
метод, обеспечивающий такое же получение
максимального
c)
для продукции со средней бионагрузкой
1)
метод
2)
метод
3)
метод 2 (см. раздел 8), при условии получения
стерилизующей дозы со значением
4)
метод, обеспечивающий получение
максимального
7 Метод 1: установление дозы с использованием информации о бионагрузке
7.1 Обоснование Рассматриваемый метод установления стерилизующей дозы зависит от экспериментальной верификации того, что стойкость бионагрузки к облучению меньше или равна стойкости микробной популяции, имеющей стандартное распределение стойкостей к облучению (SDR).
Для
значений SDR выполнен рационализированный
отбор. SDR точно определяет стойкость
микроорганизмов в значениях
Таблица 3 - Стандартное распределение стойкостей (SDR), применяемое в методе 1 (см. [20])
В
действительности определена средняя
бионагрузка. Дозу, которая дает
При обосновании допущения двух положительных результатов исходят из предположения, что вероятности появления положительных чисел в окрестности ожидания одного положительного числа распределяются по закону Пуассона. При таком распределении существует вероятность 92%, что появится ноль, один или два положительных результата (см. таблицу 4).
Таблица
4 - Ожидаемая вероятность положительных
результатов из 100 испытаний при
Примечание - Таблица В.1 ISO 11137:1995, дающая проверочную и стерилизующую дозы для метода 1, была составлена на основе использования равномерно увеличивающихся доз и соответствующего увеличения значений средних бионагрузок. Возрастание дозы было 0,1 кГр, значения средней бионагрузки увеличивались неравномерно и включали как целые, так и дробные числа (т.е. 104; 112,6; 121,9; 131,9 и т.д.). Чтобы улучшить таблицу, упростив ее для использования и интерпретации, средние значения бионагрузки в таблице 5 в ISO 11137 выражены как равномерно возрастающие целые числа. Приращения значений бионагрузки выбираются так, чтобы увеличение проверочной дозы составляло около 0,1 кГр, при этом значения дозы округляются до одного десятичного знака. Равномерные увеличения значений средней бионагрузки также включены в таблицу 6.
7.2
Порядок осуществления действий по
методу 1 для продукции со средней
бионагрузкой
7.2.1 Общее
При использовании метода 1 выполняются шесть нижеприведенных стадий.
Примечание - Рабочий пример см. 11.1.
7.2.2
Стадия 1: выбор
7.2.2.1
Значение регистрируют
7.2.2.2 Отображают как минимум 10 единиц продукции из каждой из трех независимых партий согласно 5.1, 5.2 и 5.3.
7.2.3 Стадия 2: определение средней бионагрузки
7.2.3.1 Решают, должен ли применяться поправочный коэффициент при определении бионагрузки.
Примечание - В методе, описанном в ISO 11737-1, применяется поправочный коэффициент, выведенный из валидации метода определения бионагрузки к числу жизнеспособных микроорганизмов. При установлении дозы по методу 1 можно использовать число жизнеспособных микроорганизмов без применения поправочного коэффициента. Когда поправочный коэффициент не используется, бионагрузка может быть недооценена. Неприменение поправочного коэффициента к бионагрузке может увеличить риск ошибки эксперимента с проверочной дозой.
7.2.3.2 Определяют бионагрузку каждой из выбранных единиц продукции и вычисляют:
a) для каждой из трех партий среднюю бионагрузку на единицу партии (среднее значение для партии);
b) среднюю нагрузку на единицу продукции для всех выбранных единиц продукции (общую среднюю бионагрузку).
Примечание
- Бионагрузку обычно определяют на
отдельных единицах продукции, но когда
бионагрузка низкая (например,
7.2.3.3 Сравнивают три средних значения для партии с общей средней бионагрузкой и определяют, есть ли какое-нибудь среднее значение для партии, которое вдвое или более превышает общую среднюю бионагрузку.
7.2.4 Стадия 3: получение проверочной дозы
Из
таблицы 5 получают дозу для
a)
самую высокую среднюю бионагрузку для
партии, если одно или более средних
значений для партии
b)
общую среднюю бионагрузку, если каждое
из средних значений для партии
Полученную дозу обозначить как проверочную.
Для
определения проверочной дозы используют
среднюю бионагрузку
Если средняя бионагрузка не приводится в таблице 5, используют ближайшую табличную бионагрузку, которая должна быть больше вычисленной средней бионагрузки.
7.2.5 Стадия 4: проведение эксперимента с проверочной дозой
7.2.5.1 Для выполнения стадии 4 отобрать 100 единиц из одной партии продукции. Сто единиц продукции для выполнения стадии 4 можно выбрать из одной из партий, для которых определение бионагрузки было проведено в стадии 2, или из четвертой партии, изготовленной в условиях, пригодных для нормального производства. При выборе партии для использования следует учитывать способность продукции поддерживать микробный рост.
7.2.5.2 Облучают образцы продукции с использованием проверочной дозы. Определяют дозу. Если самая высокая доза, применяемая для образцов продукции, превышает проверочную дозу более чем на 10% и стерилизующая доза устанавливается по методу 1, то эксперимент с поверочной дозой должен быть повторен. Если среднеарифметическое самой высокой и самой низкой доз, подаваемых на образцы продукции, меньше 90% проверочной дозы, эксперимент с проверочной дозой нужно повторить. Если средняя доза меньше 90% проверочной дозы и при проведении испытания на стерильность получаются приемлемые результаты (см. 7.2.6.1), то проверочный эксперимент повторять не нужно.
7.2.5.3 Для каждого облученного образца продукции отдельно проводят тест на стерильность согласно ISO 11737-2, пункт 5.4.1, и записывают число положительных результатов.
7.2.6 Стадия 5: интерпретация результатов
7.2.6.1 Если получено не более двух положительных результатов из 100 проведенных испытаний на стерильность, проверку принимают.
7.2.6.2 Если получено более двух положительных результатов, верификацию не принимают.
Если полученный результат можно отнести за счет некорректного определения бионагрузки, неприменения поправочного коэффициента при определении бионагрузки, некорректного проведения испытаний на стерильность или некорректной подачи проверочной дозы, то эксперимент с проверочной дозой можно повторить после выполнения корректирующего действия.
Если полученный результат нельзя приписать к какой-либо причине, устраняемой корректирующим действием, то этот метод установления дозы не является правильным и альтернативный метод следует использовать для установления стерилизующей дозы (см. раздел 6).
7.2.7 Стадия 6: установление стерилизующей дозы
7.2.7.1
Если продукция используется целиком и
проверка принимается, надо получить
стерилизующую дозу для продукции из
таблицы 5, используя ближайшую табличную
среднюю бионагрузку, которая больше
или равна вычисленной средней бионагрузке,
и считывая дозу, необходимую для получения
требуемого
Таблица
5 - Доза облучения, кГр, требуемая для
получения заданного
7.2.7.2
Если используется
7.3
Порядок осуществления действий по
методу 1 для продукции со средней
бионагрузкой
7.3.1 Обоснование
Рассматриваемый порядок является адаптацией метода 1 и предназначен для установления стерилизующей дозы только для единичной партии продукции. Рассматриваемый порядок метода для установления стерилизующей дозы зависит от экспериментальной верификации того, что стойкость к облучению бионагрузки меньше или равна стойкости микробной популяции, имеющей SDR.
7.3.2 Общее
При использовании метода 1 выполняются шесть нижеприведенных стадий.
Примечание - Рабочий пример см. в 11.1.
7.3.3
Стадия 1: выбор
7.3.3.1
7.3.3.2 Отбирают как минимум 10 единиц продукции из единичной партии по 5.1, 5.2 и 5.3.
7.3.4 Стадия 2: определение средней бионагрузки
7.3.4.1 Решают, должен ли применяться поправочный коэффициент при определении бионагрузки.
Примечание - В методе, описанном в ISO 11737-1, применяется поправочный коэффициент, выведенный из валидации метода определения бионагрузки к числу жизнеспособных микроорганизмов. При установлении дозы по методу 1 можно использовать это число жизнеспособных микроорганизмов без применения поправочного коэффициента. Когда поправочный коэффициент не используется, бионагрузка может быть недооценена. Неприменение поправочного коэффициента к бионагрузке может увеличить риск ошибки эксперимента с проверочной дозой.
7.3.4.2 Для всех выбранных единиц продукции определяют бионагрузку каждой из выбранных единиц продукции и вычисляют среднюю бионагрузку на единицу (общая средняя бионагрузка).
Примечание
- Бионагрузку обычно определяют на
отдельных единицах продукции, но когда
бионагрузка низкая (например,
7.3.5 Стадия 3: получение проверочной дозы
Используя
среднюю бионагрузку, получают дозу для
Если
Если средняя бионагрузка не приводится в таблице 5, то используют ближайшую табличную бионагрузку, которая больше вычисленной средней бионагрузки.
7.3.6 Стадия 4: проведение эксперимента с проверочной дозой
7.3.6.1 Из единичной партии продукции отбирают 100 единиц продукции.
7.3.6.2 С использованием проверочной дозы облучают 100 единиц продукции. Определяют дозу. Если самая высокая доза, применяемая для единиц продукции, превышает проверочную дозу более чем на 10% и стерилизующая доза должна устанавливаться по методу 1, то эксперимент с проверочной дозой должен быть повторен. Если среднеарифметическое самой высокой и самой низкой доз, подаваемых на единицы продукции, меньше 90% проверочной дозы, эксперимент с проверочной дозой следует повторить. Если полученная средняя доза меньше 90% от проверочной дозы и при проведении испытания получаются приемлемые результаты (см. 7.3.7.1), то проверочный эксперимент повторять не нужно.
7.3.6.3 Для каждой облученной единицы продукции отдельно проводят тест на стерильность согласно ISO 11737-2, пункт 5.4.1, и записывают число положительных результатов.
7.3.7 Стадия 5: интерпретация результатов
7.3.7.1 Если получено не более двух положительных результатов из 100 проведенных испытаний на стерильность, проверку принимают.
7.3.7.2 Если получено более двух положительных результатов, проверку не принимают.
Если полученный результат можно отнести за счет некорректного определения бионагрузки, неприменения поправочного коэффициента при определении бионагрузки, некорректного проведения испытаний на стерильность или некорректной подачи проверочной дозы, то эксперимент с проверочной дозой следует повторить с применением корректирующего действия.
Если полученный результат нельзя приписать к какой-либо причине, устраняемой корректирующим действием, то этот метод установления дозы не является правильным и альтернативный метод следует использовать для установления стерилизующей дозы (см. раздел 6).
7.3.8 Стадия 6: установление стерилизующей дозы
7.3.8.1
Если продукция используется целиком и
результаты проверки признаются, получают
стерилизующую дозу для продукции из
таблицы 5, используя ближайшую табличную
среднюю бионагрузку, которая больше
или равна вычисленной средней бионагрузке,
и считывая дозу, необходимую для получения
требуемого
7.3.8.2
Если используется
7.4 Порядок осуществления действий по методу 1 для продукции со средней бионагрузкой в интервале от 0,1 до 0,9 для нескольких или единичной партии продукции Для продукции со средней бионагрузкой в интервале от 0,1 до 0,9 включительно должна проводиться процедура для установления дозы по методу 1, для нескольких партий (см. 7.2) или единичной партии (см. 7.3), за исключением:
a) целая продукция должна использоваться согласно таблице 1;
b) при определении бионагрузки должен использоваться поправочный коэффициент;
с)
для получения дозы, обеспечивающей
Примечания
1 Рабочий пример см. в 11.1.
2 Табличные значения используют в стадиях 3, 4 и 6 по методу 1 установления дозы.
Таблица
6 - Доза облучения, кГр, требуемая для
получения заданного
8 Метод 2: установление дозы с использованием информации о доле положительных результатов из возрастающего дозирования для определения коэффициента экстраполяции
8.1 Обоснование
При
использовании метода 2 получают информацию
о стойкости микроорганизмов к облучению
по мере их возникновения на продукции.
В этом методе используются результаты
испытаний на стерильность, проведенных
на единицах продукции, которые облучали
с возрастанием дозы, чтобы оценить дозу,
при которой ожидается, что из 100 единиц
продукции одна будет нестерильной (т.е.
Истинность
вычисленной стерилизующей дозы обычно
зависит от обоснованности экстраполяции
за пределы дозы, ожидаемой для получения
Далее описываются две процедуры, обозначенные как метод 2А и метод 2В. Метод 2А является обычно применяемым методом, тогда как метод 2В разработан для продуктов с однородной и очень низкой бионагрузкой. Соответствующие условия для использования метода 2В установлены в 8.3.1.1.
Определение бионагрузки не используется при установлении стерилизующей дозы в методе 2. Однако определение бионагрузки требуется как часть текущего мониторинга продукции (см. ISO 11137-1:2006, пункты 7.3 и 12.1).
Вычисления
для
Для вычисления дозы следует использовать данные, которые записаны с точностью до одного десятичного знака. Стерилизующую дозу можно округлить (используя стандартные процедуры округления) до одного десятичного знака.
Примечания
1 В следующих процедурах и примерах нижний регистр (строчные буквы) используется для обозначения результатов, полученных для продукции, взятой из единичной базы. Верхний регистр (заглавные буквы) используется для обозначения результатов для продуктов, взятых из трех партий.
2
Для метода 2 продукт должен использоваться
целиком (
8.2 Порядок осуществления действий для метода 2А 8.2.1 Общее
При применении метода 2А выполняются пять следующих стадий.
Примечание - Рабочие примеры см. в 11.2.2 и 11.2.3.
8.2.2
Стадия 1: выбор
8.2.2.1
Записывают
8.2.2.2
Отбирают как минимум 280 единиц продукции
из каждой из трех независимых партий
согласно 5.1; 5.2 и 5.3. Может понадобиться
дополнительный продукт для валидации
адекватности
8.2.3 Стадия 2: проведение эксперимента с возрастающей дозой
8.2.3.1 Общее
8.2.3.1.1
В каждой из трех партий продукции
облучить 20 единиц продукции, используя
серию как минимум из девяти доз, начиная
с 2 кГр и увеличивая с номинальными
приращениями 2 кГр. Определяют каждую
возрастающую дозу. Самая высокая доза
при каждой номинальной возрастающей
дозе используется затем в идентификации
первой дробной положительной дозы
8.2.3.1.2 Для облученных единиц продукции индивидуально проводят испытание на стерильность согласно ISO 11737-2, пункт 5.4.1, и записывают число положительных результатов.
8.2.3.1.3 Из результатов эксперимента получают следующее:
a)
b)
c)
партию
8.2.3.2
8.2.3.2.1
Для каждой из трех партий продукции
определяют самую низкую дозу из серии
возрастающих доз, при которой как минимум
одно из 20 испытаний на стерильность
отрицательное. Эту дозу обозначают как
8.2.3.2.2
Значение
Таблица
7 - Значения
8.2.3.2.3
Вычисляют
8.2.3.3
8.2.3.3.1
Для каждой из трех партий продукции
определяют
a) путем нахождения более низкой из двух последовательных доз, при которой все испытания на стерильность отрицательные с последующим не более чем одним положительным результатом в любом из остальных испытаний с серией возрастающих доз;
b) путем нахождения дозы, при которой имеет место один положительный результат из 20 испытаний на стерильность, которому непосредственно предшествует одна и только одна возрастающая доза, при которой все испытания отрицательные, и с последующими возрастающими дозами, при которых все испытания отрицательные.
8.2.3.3.2 Если критерии в 8.2.3.3.1, перечисление а) или b), не удовлетворяются каждой из трех партий продукции, эксперимент с возрастающей дозой считается неудавшимся. В этом случае эксперимент с возрастающей дозой можно повторить после изучения методологии эксперимента и выполнения корректирующих действий.
8.2.3.3.3
Обозначить
a)
если самое высокое значение
b)
если самое высокое значение
8.2.3.4
Партия
Определяют
партию, для которой
8.2.4 Стадия 3: проведение эксперимента с проверочной дозой
8.2.4.1
100 единиц продукции из партии
8.2.4.2
Провести тест на стерильность для каждой
облученной единицы продукции отдельно
согласно ISO 11737-2 (см. 5.4.1) и записать число
положительных результатов. Обозначить
эту величину как
8.2.5 Стадия 4: анализ результатов
Первую
неположительную дозу
a)
если
b)
если 2
c)
если 9
d)
если
8.2.6 Стадия 5: установление стерилизующей дозы
8.2.6.1
Если
Примечание
- При использовании уравнения (3), если
Если
8.2.6.2
Устанавливают
Примечание
- Если
8.2.6.3 Стерилизующую дозу вычисляют, используя уравнение (6).
где
Для вычисления дозы следует использовать данные, записанные с точностью до одного десятичного знака. Стерилизующую дозу можно округлить до одного десятичного знака (используя стандартную процедуру округления).
Примечание
-
8.3 Порядок осуществления действий для метода 2В 8.3.1 Общее
8.3.1.1 При применении метода 2В должны быть удовлетворены следующие три требования:
a)
используется продукт целиком (
b) после облучения при любой из возрастающих доз число наблюдаемых положительных испытаний на стерильность не превышает 14;
c)
Примечание - Рабочие примеры см. в 11.2.4.
8.3.2
Стадия 1: выбор
8.3.2.1
8.3.2.2 Отбирают как минимум 260 единиц продукции из каждых трех независимых партий продукции согласно 5.1, 5.2 и 5.3.
8.3.3 Стадия 2: проведение эксперимента с возрастающей дозой
8.3.3.1 Общее
8.3.3.1.1
В каждой из трех партий продукции
облучают 20 единиц продукции, используя
серию как минимум из восьми доз, начиная
с 1 кГр и увеличивая с номинальными
приращениями 1 кГр. Определяют каждую
возрастающую дозу. Самая высокая доза
при каждой номинальной возрастающей
дозе используется затем в идентификации
8.3.3.1.2 Для облученных единиц продукции индивидуально проводят испытание на стерильность согласно ISO 11737-2 (пункт 5.4.1) и записывают число положительных результатов.
8.3.3.1.3 Из результатов эксперимента получают следующее:
а)
в)
с)
партию
8.3.3.2
8.3.3.2.1
Для каждой из трех партий продукции
определяют самую низкую дозу из серии
возрастающих доз, при которой как минимум
одно из 20 испытаний на стерильность
отрицательное. Обозначают эту дозу как
8.3.3.2.2
Значение
Таблица
8 - Значения
8.3.3.2.3
8.3.3.3
8.3.3.3.1
Для каждой из трех партий продукции
определяют
a) путем нахождения более низкой из двух последовательных доз, при которой все испытания на стерильность отрицательные с последующим не более чем одним положительным результатом в любом из остальных испытаний с серией возрастающих доз;
b) путем нахождения дозы, при которой имеет место один положительный результат из 20 испытаний на стерильность, которому непосредственно предшествует одна и только одна возрастающая доза, при которой все испытания отрицательные, и за которым следуют возрастающие дозы, при которых все испытания отрицательные.
8.3.3.3.2 Если критерии в 8.3.3.3.1 перечисление а) или b) не удовлетворяются каждой из трех партий продукции, эксперимент с возрастающей дозой считается несостоятельным. В этом случае эксперимент с возрастающей дозой можно повторить после изучения методологии эксперимента и выполнения корректирующих действий.
8.3.3.3.3
Обозначают
a)
если самое высокое значение
b)
если самое высокое значение
8.3.3.4
Партия
Партию,
для которой
8.3.4 Стадия 3: проведение эксперимента с проверочной дозой
8.3.4.1
100 единиц продукции облучают из партии
8.3.4.2
Проводят тест на стерильность для каждой
облученной единицы продукции отдельно
согласно ISO 11737-2 (пункт 5.4.1) и записывают
число положительных результатов. Это
значение записывают как
8.3.5 Стадия 4: рассмотрение результатов
a)
если
b)
если 2
c)
если 9
d)
если
8.3.6 Стадия 5: установление стерилизующей дозы
8.3.6.1
Примечание
- При использовании уравнения (8), если
8.3.6.2
Примечание
- Если
8.3.6.3 Стерилизующую дозу вычисляют, используя уравнение (9).
где
9
Метод
9.1 Обоснование
Функционально
метод
При
выполнении обоснования данный метод
верифицирует, что бионагрузка,
присутствующая на продукте до стерилизации,
менее стойка к облучению, чем микробная
популяция максимальной стойкости,
соответствующей достижению
Фактически
выполняется определение средней
бионагрузки. Доза
Методы
с
Примечание
- Проверка значений
9.2
Процедура для метода
9.2.1 Общее
9.2.1.1
Процедура для метода
9.2.1.2
При применении
9.2.1.3
При применении метода
Примечание - Рабочие примеры см. в 11.3.
9.2.2 Стадия 1: получение образцов продукции
Выбирают как минимум 10 единиц продукции из каждых трех независимых партий продукции согласно 5.1, 5.2 и 5.3.
9.2.3 Стадия 2: определение средней бионагрузки
9.2.3.1 Поправочный коэффициент (см. ISO 11737-1) применяют при определении бионагрузки.
9.2.3.2 Бионагрузку определяют каждой выбранной единицы продукции и вычисляют:
a) среднюю бионагрузку на единицу для каждой из трех партий (среднее значение для партии);
b) среднюю бионагрузку на единицу для выбранных единиц продукции (общая средняя бионагрузка).
Примечание
- Бионагрузку обычно определяют на
индивидуальных единицах продукции, но
когда бионагрузка низкая (например,
9.2.3.3 Три средних значения для партий с общей средней бионагрузкой сравнивают и определяют, превышает ли любое из средних значений в два раза или более общую среднюю бионагрузку.
9.2.4
Стадия 3: получение
a)
самое высокое среднее значение для
партии, если одно или более средних
значений для партии
или
b)
общую среднюю бионагрузку, если каждое
из средних значений для партии
Для
Для
Примечание
- Для продукции со средней бионагрузкой
Таблица
9 - Значения
Уравнение
(10) применяют для вычисления
9.2.5 Стадия 4: выполнение эксперимента с проверочной дозой
9.2.5.1 Выбрать 10 единиц продукции из единичной партии. Эти 10 единиц продукции для выполнения стадии 4 можно выбрать из одной из партий, для которой проводилось определение бионагрузки в стадии 2, или из четвертой партии, полученной в условиях репрезентативных для нормального производства. При выборе партии должна учитываться способность продукции поддерживать микробный рост.
9.2.5.2
Облучить 10 единиц продукции при
Примечание
- Если
9.2.5.3 Единицы продукции (см. 9.2.5.2) индивидуально испытывают на стерильность согласно ISO 11737-2 (пункт 5.4.1) и записывают число положительных результатов.
9.2.6 Стадия 5: интерпретация результатов
9.2.6.1 Верификацию принимают, если будет не более одного положительного теста на стерильность из 10 проведенных испытаний и тем самым можно подтвердить значение 25 кГр как стерилизующей дозы.
9.2.6.2 Если будет два положительных теста на стерильность из 10 проведенных испытаний, проводят подтверждающий эксперимент с проверочной дозой (см. 9.2.7).
9.2.6.3 Если будет более двух положительных тестов на стерильность верификацию не принимают.
Если полученный результат можно приписать некорректному проведению определения бионагрузки, некорректному проведению испытаний на стерильность или некорректной подаче проверочной дозы, то эксперимент с проверочной дозой следует повторить после выполнения корректирующего действия.
Если полученный результат нельзя объяснить никакой причиной, которую можно исправить корректирующим действием, то данный метод обоснования дозы является недостоверным и используется альтернативный метод для обоснования 25 кГр как стерилизующей дозы (см. раздел 6).
9.2.7 Эксперимент, подтверждающий проверочную дозу
9.2.7.1 Общее
Если нужно проводить подтверждающий эксперимент с проверочной дозой (см. 9.2.6.2), то выполняются три следующие стадии (см. 9.2.7.2, 9.2.7.3 и 9.2.7.4).
9.2.7.2 Стадия 1: получение образцов продукции
Из единичной партии выбирают как минимум 10 единиц продукции. Эти 10 единиц продукции для проведения подтверждающего эксперимента с проверочной дозой можно выбрать из одной из партий, на которой проводилось определение бионагрузки в стадии 2 (см. 9.2.3), из четвертой партии, используемой в стадии 4 (см. 9.2.5), или из партии, приготовленной в условиях, которые характерны для обычного производства. При выборе партии следует учитывать способность продукции поддерживать микробный рост.
9.2.7.3 Стадия 2: проведение подтверждающего эксперимента с проверочной дозой
9.2.7.3.1
Облучить 10 единиц продукции при
9.2.7.3.2 Единицы продукции индивидуально испытывают на стерильность согласно ISO 11737-2 (пункт 5.4.1) и записывают число положительных результатов.
9.2.7.4 Стадия 3: интерпретация результатов
9.2.7.4.1 Если из 10 проведенных испытаний не получено положительных тестов на стерильность, что дает в целом два положительных теста на стерильность, полученных при первоначальной проверке и подтверждающем эксперименте с проверочной дозой, проверку принимают и тем самым подтверждают значение 25 кГр как стерилизующей дозы.
9.2.7.4.2 Если получены положительные тесты на стерильность, верификацию не принимают.
Если полученный результат можно приписать некорректному проведению определения бионагрузки, некорректному проведению испытаний на стерильность или некорректной подаче проверочной дозы, то эксперимент с проверочной дозой следует повторить после выполнения корректирующего действия.
Если этот результат нельзя объяснить никакой причиной, которую можно исправить корректирующим действием, то данный метод обоснования 25 кГр как стерилизующей дозы является недостоверным и используется альтернативный метод для обоснования 25 кГр как стерилизующей дозы (см. раздел 6).
9.3
Процедура для метода
9.3.1 Обоснование
Процедура
для метода
9.3.2 Общее
9.3.2.1
Метод применяется только в том случае,
если средняя бионагрузка
9.3.2.2
При применении
9.3.2.3
При применении адаптации метода
9.3.3 Стадия 1: получение образцов продукции
Выбирают как минимум 10 единиц продукции из единичной базы согласно 5.1, 5.2 и 5.3.
9.3.4 Стадия 2: определение средней бионагрузки
9.3.4.1 При определении бионагрузки применяют поправочный коэффициент (см. ISO 11737-1).
9.3.4.2 Определяют бионагрузку каждой из выбранных единиц продукции и вычисляют среднюю бионагрузку.
Примечание
- Бионагрузку обычно определяют на
отдельных единицах продукции, но когда
бионагрузка низкая (например, меньше
10), допустимо объединять 10 единиц
продукции для определения средней
бионагрузки на партию. Это указание не
относится к
9.3.5
Стадия 3: получение
a)
Для
b)
Для
Примечание
- Использование
Уравнение
(10) используют для вычисления
9.3.6 Стадия 4: проведение эксперимента с проверочной дозой
9.3.6.1 Выбирают 10 единиц продукции из единичной партии продукции.
9.3.6.2
10 единиц продукции или их частей облучают
в соответствующих случаях при
Примечание
- Если
9.3.6.3 Каждую облученную единицу продукции (см. 9.3.6.2) индивидуально испытывают на стерильность согласно ISO 11737-2 (пункт 5.4.1) и записывают число положительных тестов на стерильность.
9.3.7 Стадия 5: интерпретация результатов
9.3.7.1 Если из 10 проведенных испытаний получено не более одного положительного теста на стерильность, принимают проверку и тем самым подтверждают значение 25 кГр как стерилизующей дозы.
9.3.7.2 Если в 10 проведенных испытаниях будет два положительных теста на стерильность, выполняют подтверждающий эксперимент с проверочной дозой (см. 9.2.7).
9.3.7.3 Если будет более двух положительных тестов на стерильность, проверку не принимают.
Если полученный результат можно приписать некорректному проведению определения бионагрузки, некорректному проведению испытаний на стерильность или некорректной подаче проверочной дозы, то эксперимент с проверочной дозой следует повторить после выполнения корректирующего действия.
Если полученный результат нельзя объяснить никакой причиной, которую можно исправить корректирующим действием, то данный метод обоснования 25 кГр как стерилизующей дозы является недостоверным и используется альтернативный метод для обоснования 25 кГр как стерилизующей дозы (см. раздел 6).
9.4
Процедура для метода
9.4.1 Общее
9.4.1.1 Этот метод используется только в том случае, если средняя бионагрузка продукции меньше или равна 1,5.
9.4.1.2
При применении метода
9.4.1.3
При применении метода
Примечание - Рабочие примеры см. 11.3.
9.4.2 Стадия 1: получение образцов продукции
Выбирают как минимум 10 единиц продукции из каждых трех независимых партий продукции согласно 5.1, 5.2 и 5.3.
9.4.3 Стадия 2: определение средней бионагрузки
9.4.3.1 Поправочный коэффициент применяют при определении бионагрузки (см. ISO 11737-1).
9.4.3.2 Определяют бионагрузку каждой из выбранных единиц продукции и вычисляют:
a) среднюю бионагрузку на единицу для каждой из трех партий (среднее значение для партии);
b) среднюю бионагрузку на единицу для выбранных единиц продукции (общая средняя бионагрузка).
Примечание
- Бионагрузку обычно определяют на
отдельных единицах продукции, но когда
бионагрузка низкая (например, меньше
10), допустимо объединять 10 единиц
продукции для определения средней
бионагрузки для партии. Это указание
не относится к
9.4.3.3 Сравнивают три средних значения для партии с общей средней бионагрузкой и определяют, есть ли какое-нибудь среднее значение для партии, которое в два или три раза больше общей средней бионагрузки.
9.4.4
Стадия 3: получение
Получают
a)
самое высокое среднее значение для
партии, если одно или более средних
значений
b)
общую среднюю бионагрузку, если каждая
из средних значений для партии
Если средняя бионагрузка не приведена в таблице 10, используют ближайшую табличную среднюю бионагрузку, которая больше вычисленной средней бионагрузки.
Таблица
10 - Значения
9.4.5 Стадия 4: проведение эксперимента с проверочной дозой
9.4.5.1 Отбирают 10 единиц продукции из единичной партии продукции. Эти 10 единиц продукции для выполнения стадии 4 можно выбрать из одной какой-либо партии, для которой определение бионагрузки было проведено в стадии 2, или из четвертой партии, изготовленной в условиях, репрезентативных для нормального производства. При выборе партии для использования следует учитывать способность продукции поддерживать микробный рост.
9.4.5.2
Облучают единицы продукции при
Примечание
- Если
9.4.5.3 Тест на стерильность для каждой облученной единицы продукции проводят отдельно согласно ISO 11737-2 (пункт 5.4.1) и записывают число положительных результатов.
9.4.6 Стадия 5: интерпретация результатов
9.4.6.1 Если из 10 проведенных испытаний получено не более одного положительного теста на стерильность, проверку принимают и тем самым подтверждают 15 кГр как стерилизующую дозу.
9.4.6.2 Если из 10 проведенных испытаний получено два положительных теста на стерильность, проводят подтверждающий эксперимент с проверочной дозой (см. 9.4.7).
9.4.6.3 Если получено более двух положительных тестов на стерильность, проверку не принимают.
Если полученный результат можно отнести за счет некорректного определения бионагрузки, некорректного проведения испытаний на стерильность или некорректной подачи проверочной дозы, то эксперимент с проверочной дозой можно повторить после выполнения корректирующего действия.
Если полученный результат нельзя приписать к какой-либо причине, устраняемой корректирующим действием, то этот метод обоснования 15 кГр является недостоверным и следует использовать альтернативный метод для подтверждения 15 кГр как стерилизующей дозы (см. раздел 6).
Если существует любое из этих условий, то эксперимент с проверочной дозой можно повторить.
9.4.7 Подтверждающий эксперимент с проверочной дозой
9.4.7.1 Общее
Если должен проводиться подтверждающий эксперимент с проверочной дозой (см. 9.4.6.2), выполняются три нижеприведенные стадии.
9.4.7.2 Стадия 1: получение образцов продукции
Выбирают как минимум 10 единиц продукции из единичной партии. Эти 10 единиц продукции для проведения подтверждающего эксперимента с проверочной дозой можно выбрать из одной какой-либо партии, на которой проводилось определение бионагрузки в стадии 2 (см. 9.4.3), из четвертой партии, используемой в стадии 4 (см. 9.4.5), или из партии приготовленной в условиях, которые характерны для обычного производства. При выборе партии следует учитывать способность продукции поддерживать микробный рост.
9.4.7.3 Стадия 2: проведение подтверждающего эксперимента с проверочной дозой
9.4.7.3.1
Облучают 10 единиц продукции при
9.4.7.3.2 Каждую облученную единицу продукции испытывают на стерильность индивидуально согласно ISO 11737-2 (пункт 5.4.1) и записывают число положительных тестов на стерильность.
9.4.7.4 Стадия 3: интерпретация результатов
9.4.7.4.1 Если из 10 проведенных испытаний не получено положительных тестов на стерильность, что дает в целом два положительных результата, полученных в первоначальных экспериментах с верификацией и с подтверждением проверочной дозы, принимают проверку и тем самым подтверждают значение 15 кГр как стерилизующей дозы.
9.2.7.4.2 Если получено более двух положительных тестов на стерильность, проверку не принимают.
Если полученный результат можно приписать некорректному проведению определения бионагрузки, некорректному проведению испытаний на стерильность или некорректной подаче проверочной дозы, то подтверждающий эксперимент с проверочной дозой можно повторить после выполнения корректирующего действия.
Если полученный результат нельзя объяснить какой-либо причиной, которую можно исправить корректирующим действием, то данный метод обоснования 15 кГр как стерилизующей дозы является недостоверным и используется альтернативный метод для обоснования 15 кГр как стерилизующей дозы (см. раздел 6).
9.5
Процедура для метода
9.5.1 Обоснование
Эта
процедура является адаптацией метода
9.5.2 Общее
9.5.2.1 Процедура используется только в том случае, если средняя бионагрузка продукта меньше или равна 1,5.
9.5.2.2
При применении метода
9.5.2.3
При применении адаптации метода
9.5.3 Стадия 1: получение образцов продукции
Выбирают как минимум 10 единиц продукции из единичной партии 5.1, 5.2 и 5.3.
9.5.4 Стадия 2: определение средней бионагрузки
9.5.4.1 Поправочный коэффициент применяют при определении бионагрузки (см. ISO 11737-1).
9.5.4.2 Определяют бионагрузку каждой из выбранных единиц продукции и вычисляют среднюю бионагрузку.
Примечание
- Бионагрузку обычно определяют на
отдельных единицах продукции, но когда
бионагрузка низкая (например, меньше
10), допустимо объединять 10 единиц
продукции для определения средней
бионагрузки для партии. Это указание
не относится к
9.5.5
Стадия 3: получение
9.5.6 Стадия 4: выполнение эксперимента с проверочной дозой
9.5.6.1 Выбирают 10 единиц продукции из единичной партии продукции.
9.5.6.2
Облучают единицы продукции при
Примечание
- Если
9.5.6.3 Каждую единицу продукции испытывают на стерильность (пункт 9.5.6.2) индивидуально согласно ISO 11737-2 (пункт 5.4.1) и записывают число положительных тестов на стерильность.
9.5.7 Стадия 5: интерпретация результатов
9.5.7.1 Проверку принимают, если получено более одного положительного теста на стерильность из 10-ти проведенных испытаний и тем самым подтверждают значение 15 кГр как стерилизующей дозы.
9.5.7.2 Проводят подтверждающий эксперимент с проверочной дозой (см. 9.4.7), если получено два положительных теста на стерильность из 10-ти проведенных испытаний.
9.5.7.3 Если получится более двух положительных тестов на стерильность, проверку не принимают.
Если полученный результат можно приписать некорректному проведению определения бионагрузки, некорректному проведению испытаний на стерильность или некорректной подаче проверочной дозы, то эксперимент с проверочной дозой можно повторить после выполнения корректирующего действия.
Если полученный результат нельзя объяснить какой-либо причиной, которую можно исправить корректирующим действием, то данный метод обоснования дозы является недостоверным и используют альтернативный метод для обоснования 15 кГр как стерилизующей дозы (см. раздел 6)
Если выполняется любое из этих условий, тогда эксперимент с проверочной дозой можно повторить.
10 Проведение проверки стерилизующей дозы
10.1 Цель и частота Когда стерилизующая доза установлена, проводятся периодические проверки для подтверждения эффективности дозы. Частота проведения проверок соответствует ISO 11137-1:2006 (подраздел 12.1). Проведение проверок дозы не требуется в течение тех периодов, когда продукция не производится. Совместно с проверками стерилизующей дозы следует проводить обследование условий и состояния производства и определений бионагрузки. Если проверка показывает отсутствие контроля, следует принимать соответствующие меры.
10.2 Процедура для проведения проверки стерилизующей дозы, установленной с использованием метода 1 или 2 10.2.1 Общее
10.2.1.1
Для проведения проверки стерилизующей
дозы, установленной методом 1 или 2,
используют
10.2.1.2 При проведении проверки стерилизующей дозы следует выполнить четыре нижеприведенные стадии.
Примечание - Рабочие примеры см. 11.4 и 11.5.
10.2.2 Стадия 1: получение образцов продукции
Выбирают как минимум 110 единиц продукции из единичной партии согласно 5.1, 5.2 и 5.3.
10.2.3 Стадия 2: определение средней бионагрузки
Бионагрузку определяют как минимум из 10 единиц продукции и вычисляют среднюю бионагрузку. Если при установлении первоначальной стерилизующей дозы использовался поправочный коэффициент (см. ISO 11737-1), то нужно использовать тот же самый поправочный коэффициент в проверке стерилизующей дозы.
Примечания
1
Бионагрузку обычно определяют на
отдельных единицах продукции, но когда
бионагрузка низкая (например, меньше
10), допустимо объединять 10 единиц
продукции для определения средней
бионагрузки на партию. Это указание не
относится к
2 Данные бионагрузки не предназначены для использования при получении проверочной дозы для проверки стерилизующей дозы. Эти данные используются для мониторинга процесса и его управления (например, трендовый анализ, исследование отказов, проверка стерилизующей дозы или уменьшение частоты проведения проверок стерилизующей дозы).
10.2.4 Стадия 3: проведение эксперимента с проверочной дозой
10.2.4.1
Облучают 100 единиц продукции при
проверочной дозе или
10.2.4.2 Испытывать на стерильность каждую облученную единицу продукции (см. 10.2.4.1) индивидуально в условиях окружающей среды и инкубации, применяемых в эксперименте установления первоначальной дозы и записывают число положительных тестов на стерильность.
10.2.5 Стадия 4: интерпретация результатов
10.2.5.1 Если получено не более двух положительных тестов на стерильность из 100 проведенных испытаний, проверку принимают.
10.2.5.2
Если получено три или четыре положительных
теста на стерильность из 100 проведенных
испытаний и результат не может быть
приписан некорректному проведению
испытания или некорректной подаче
проверочной дозы, немедленно увеличивают
стерилизующую дозу (см. 10.2.6). Повторяют
проверку стерилизующей дозы, используя
следующие 100 единиц продукции и такую
же проверочную дозу или
10.2.5.3 Если получено от 5 до 15 положительных тестов на стерильности в 100 испытаниях, то стерилизующая доза недостаточна; ее нужно немедленно увеличить (см. 10.2.6).
Если получение пяти или более положительных тестов на стерильность можно отнести за счет некорректного проведения испытания или некорректной подачи проверочной дозы, то надо выполнить корректирующее действие и повторить проверку стерилизующей дозы. Интерпретируют результаты согласно 10.2.5.5.
Если получение пяти или более положительных тестов на стерильность можно связать со специфической бионагрузкой, выполнить корректирующее действие и повторить проверку стерилизующей дозы. Интерпретируют результаты согласно 10.2.5.5.
Если получение пяти или более положительных тестов на стерильность нельзя приписать никаким вышеназванным причинам, проверка не принимается; установленная ранее доза считается недостоверной. Повторно установить стерилизующую дозу, используя другой метод (см. раздел 6), и наращивать стерилизующую дозу, пока ее повторное установление не будет выполнено.
10.2.5.4 Если будет получено более 15 положительных результатов, стерилизующую дозу не нужно увеличивать. Если этот результат нельзя приписать некорректному проведению испытания на стерильность или некорректной подаче проверочной дозы, стерилизацию при ранее установленной дозе прерывают и не возобновляют, пока стерилизующая доза не будет снова установлена другим методом (см. раздел 6).
10.2.5.5 Результаты повторной проверки стерилизующей дозы, проведенной согласно 10.2.5.2 или 10.2.5.3, интерпретируют следующим образом:
a) если получено не более двух положительных тестов на стерильность в 100 испытаниях, и обследование условий и состояния производства, и определений бионагрузки не показывает никаких значений вне установленных технических условий, можно возобновить использование первоначальной стерилизующей дозы;
b) если три или четыре положительных теста на стерильность получены в 100 испытаниях, необходимо немедленно повторно установить стерилизующую дозу и продолжить использовать повышенную стерилизующую дозу, пока повторное установление стерилизующей дозы не будет выполнено;
c) если получено от 5 до 15 положительных тестов на стерильность в 100 испытаниях, повторно устанавливают стерилизующую дозу, используя другой метод (см. раздел 6), и продолжают использовать повышенную стерилизующую дозу, пока повторное установление стерилизующей дозы не будет выполнено;
d) если получено более 15-ти положительных тестов в 100 испытаниях, стерилизующую дозу не нужно увеличивать; стерилизацию при ранее установленной дозе прерывают и не возобновляют, пока стерилизующая доза не будет снова установлена другим методом (см. раздел 6).
10.2.6 Увеличение стерилизующей дозы с использованием метода 1, 2А или 2В
10.2.6.1 Общее
Метод увеличения стерилизующей дозы, установленной с использованием метода 1, 2А или 2В, основан на методе, предложенном [11]. В методе используется информация полученная при проверке неудовлетворительной стерилизующей дозы, и основные принципы метода 2 вместе с консервативной оценкой стойкости к облучению большинства компонентов микробной популяции продукта.
10.2.6.2 Стадия 1: анализирование данных проверки с непринятием стерилизующей дозы
a) Идентифицировать самую высокую дозу, измеренную в проверке стерилизующей дозы. Обозначить ее как "максимальную дозу проверки".
b) Записать число положительных испытаний на стерильность, определенных в проверке стерилизующей дозы (см. 10.2.5.2 и 10.2.5.3). Обозначить это число как "число положительных тестов проверки".
10.2.6.3 Стадия 2: определение коэффициента экстраполяции
a)
Значение
Если число положительных тестов проверки от 3 до 9 включительно, используют уравнение:
Если число положительных тестов проверки от 10 до 15 включительно, используют уравнение:
b)
Вычисляют коэффициент экстраполяции,
используя уравнение (13) или (14), в
зависимости от значения
Если
Если
Если вычисление с использованием уравнения (13) или (14) дает значение больше чем 4,2 кГр, устанавливают коэффициент экстраполяции, равный 4,2 кГр.
10.2.6.4
Стадия 3: вычисление скорректированной
дозы (доза для получения значения
10.2.6.5 Стадия 4: вычисление увеличенной стерилизующей дозы
Для метода 1 и 2А вычисляют увеличенную стерилизующую дозу по уравнению:
Для метода 2В вычисляют увеличенную стерилизующую дозу по уравнению:
10.3
Процедура проверки стерилизующей дозы,
обоснованной с использованием метода
10.3.1 Общее
10.3.1.1
Для проведения проверки стерилизующей
дозы, установленной методом
10.3.1.2 При проведении проверки стерилизующей дозы следует выполнить четыре нижеприведенные стадии:
Примечание - Рабочие примеры см. 11.6.
10.3.2 Стадия 1: получение образцов продукции
Отбирают как минимум 20 единиц продукции из единичной партии согласно 5.1, 5.2 и 5.3.
10.3.3 Стадия 2: определение средней бионагрузки
10.3.3.1 При определении бионагрузки применяют такой же поправочный коэффициент (см. ISO 11737-1), который использовался при обосновании стерилизующей дозы.
10.3.3.2 Определяют бионагрузку каждой партии из как минимум 10 единиц продукции и вычисляют среднюю бионагрузку.
Примечания
1
Бионагрузку обычно определяют на
отдельных единицах продукции, но когда
бионагрузка низкая (например, меньше
10), допустимо объединять 10 единиц
продукции для определения средней
бионагрузки для партии. Это указание
не относится к
2 Данные бионагрузки не предназначены для получения стерилизующей дозы для проверки. Эти данные используются для мониторинга и контроля процесса (например, трендовый анализ, исследование отказов, проверка стерилизующей дозы или сокращение частоты проведения проверок).
10.3.4 Стадия 3: проведение эксперимента с проверочной дозой
10.3.4.1
Облучают 10 единиц продукции или их
частей, если уместно, которые использовались
в процессе обоснования при
10.3.4.2 Испытывают на стерильность каждую из облученных единиц продукции или их частей индивидуально в условиях окружающей среды и инкубации, применяемых в процессе обоснования первоначальной дозы. Записывают число положительных тестов на стерильность.
10.3.5 Стадия 4: интерпретация результатов
10.3.5.1 Если в 10 проведенных испытаниях получено не более одного положительного теста на стерильность, проверку стерилизующей дозы принимают.
10.3.5.2 Если в 10 проведенных испытаниях получено два положительных теста на стерильность, проводят подтверждающую проверку стерилизующей дозы (см. 10.3.6).
10.3.5.3 Если три или более положительных тестов на стерильность получены в 10 проведенных испытаниях и этот результат нельзя отнести за счет некорректного проведения испытаний на стерильность или некорректной подачи проверочной дозы, стерилизующая доза неадекватна.
a) если от трех до шести положительных тестов на стерильность получено в 10 проведенных испытаниях и этот результат нельзя отнести за счет некорректного проведения испытаний на стерильность или некорректной подачи проверочной дозы, надо немедленно увеличить дозу (см. 10.3.7). Стерилизация при ранее установленной дозе прерывается, и стерилизующую дозу увеличивают до тех пор, пока она не будет снова установлена с использованием другого метода (см. раздел 6).
b) если семь или больше положительных тестов на стерильность получено в 10 проведенных испытаниях и этот результат нельзя отнести за счет некорректного проведения испытаний на стерильность или некорректной подачи проверочной дозы, необходимо прервать стерилизацию при ранее установленной дозе. Стерилизующую дозу не нужно увеличивать и стерилизацию не нужно возобновлять до тех пор, пока доза не будет снова установлена с использованием другого метода (см. раздел 6).
Если получение трех или более положительных тестов на стерильность можно отнести за счет некорректного проведения испытаний на стерильность или некорректной подачи проверочной дозы, выполняют корректирующее действие и повторяют проверку стерилизующей дозы. Интерпретируют результаты согласно 10.3.5.
Если
причину отказа можно отнести за счет
изменения производственного процесса,
его условий или составляющих, то можно
определить временные рамки, в которых
произошло это изменение, таким образом
идентифицировать партии продукции, на
которые эти изменения могли повлиять.
Следует определить любое воздействие
на
10.3.6 Подтверждающая проверка стерилизующей дозы
10.3.6.1 Общее
10.3.6.1.1
Для проведения проверки стерилизующей
дозы, установленной методом
10.3.6.1.2 При проведении проверки стерилизующей дозы следует выполнить три нижеприведенные стадии, приведенные ниже.
10.3.6.2 Стадия 1: получение образцов продукции
Выбирают как минимум 10 единиц продукции из единичной партии согласно 5.1, 5.2 и 5.3. Эти 10 единиц продукции для проведения подтверждающей проверки стерилизующей дозы можно выбирать или из партии, используемой в 10.3.2 для эксперимента с проверочной дозой, проводимого при первоначальной проверке стерилизующей дозы (см. 10.3.2), или из второй партии, приготовленной в условиях, которые характерны для нормального производства. При выборе партии следует учитывать способность продукции поддерживать микробный рост.
10.3.6.3 Стадия 2: провести подтверждающий эксперимент с проверочной дозой
10.3.6.3.1
Облучают 10 единиц продукции при полученных
первоначально
10.3.6.3.2 Испытывают на стерильность каждую облученную единицу продукции индивидуально в условиях окружающей среды и инкубации, применяемых в процессе обоснования первоначальной дозы, и записывают число положительных результатов.
10.3.6.4 Стадия 3: интерпретация результатов
10.3.6.4.1 Принимают верификацию и тем самым подтверждают стерилизующую дозу, если из 10 проведенных испытаний не получено положительных тестов на стерильность, что дает, в целом, два положительных результата, полученных в экспериментах с проверкой и с подтверждением проверочной дозы.
10.3.6.4.2 Если один или более положительных тестов на стерильность получены в 10 проведенных экспериментах с подтверждением проверочной дозы и этот результат нельзя отнести за счет некорректного проведения испытаний на стерильность или некорректной подачи проверочной дозы, стерилизующая доза неадекватна.
a) если от одного до четырех положительных тестов на стерильность получено в 10 испытаниях, проведенных в подтверждающем эксперименте с проверочной дозой и этот результат нельзя отнести за счет некорректного проведения испытаний на стерильность или некорректной подачи проверочной дозы, надо немедленно увеличить дозу (см. 10.3.7). Стерилизация при ранее установленной дозе прерывается, и стерилизующую дозу увеличивают до тех пор, пока она не будет снова установлена с использованием другого метода (см. раздел 6).
b) если пять или больше положительных тестов на стерильность получено в 10 испытаниях, проведенных в подтверждающем эксперименте с проверочной дозой и этот результат нельзя отнести за счет некорректного проведения испытаний на стерильность или некорректной подачи проверочной дозы, надо прервать стерилизацию при ранее установленной дозе. Стерилизующую дозу не нужно увеличивать и стерилизацию не нужно возобновлять до тех пор, пока доза не будет снова установлена с использованием другого метода (см. раздел 6).
Если получение одного или более положительных тестов на стерильность можно отнести за счет некорректного проведения испытаний на стерильность или некорректной подачи проверочной дозы, выполняют корректирующее действие и повторяют проверку стерилизующей дозы согласно 10.3.5.
Если
причину отказа можно отнести за счет
изменения производственного процесса,
его условий или составляющих, можно
определить временные рамки, в которых
произошло это изменение, и таким образом
идентифицировать партии продукции, на
которые эти изменения могли повлиять.
Следует определить любое воздействие
на
10.3.7
Увеличение стерилизующей дозы,
обоснованной с использованием метода
10.3.7.1
10.3.7.1.1 Из таблицы 11 получают значение увеличения дозы, соответствующее средней бионагрузке, определенной согласно 10.3.3. Если средняя бионагрузка не приведена в таблице 11, для получения значения увеличения дозы используют ближайшую табличную среднюю бионагрузку, которая больше вычисленной средней бионагрузки. Используют это последнее значение для вычисления увеличенной стерилизующей дозы 25 кГр в уравнении
Таблица
11 - Значения увеличения дозы по методу
10.3.7.1.2
Часто причина отказа в процессе проверки
дозы не может быть идентифицирована. В
таких случаях невозможно оценить степень
различных воздействий на
10.3.7.2
Из таблицы 12 получают значение увеличения дозы, соответствующее средней бионагрузке, вычисленной в 10.3.3. Если средняя бионагрузка не приведена в таблице 12, надо использовать ближайшую табличную среднюю бионагрузку, которая больше вычисленной средней бионагрузки. Для вычисления увеличенной стерилизующей дозы используют это последнее значение в уравнении
Таблица
12 - Значения увеличения дозы по методу
11 Рабочие примеры
11.1 Рабочие примеры для метода 1
Для
метода 1 приводятся три рабочих примера.
Первый предназначен для продукции,
которую можно было испытывать для
проверки целиком (
Таблица
13 - Определение стерилизующей дозы
(метод 1,
Таблица
14 - Определение стерилизующей дозы
(метод 1,
Таблица
15 - Определение стерилизующей дозы
(метод 1,
11.2 Рабочие примеры для метода 2 11.2.1 Общее
Для
метода 2 представлено два рабочих
примера: один для продукции, которую
можно испытывать, используя единицу
продукции целиком (
В следующих примерах обозначение строчным шрифтом применяется для результатов, полученных для продукции из единичной партии, а заглавным шрифтом - для результатов, полученных для продукции из всех трех партий.
11.2.2
Рабочие примеры для метода 2А (
11.2.2.1
Стадия 1: выбор
11.2.2.1.1
Для конечного использования продукции
требуется
11.2.2.1.2 Распределение продукции для эксперимента с возрастающей дозой показано в таблице 16.
Таблица 16 - Число единиц продукции для облучения при различных возрастающих дозах
11.2.2.2 Стадия 2: проведение эксперимента с возрастающей дозой
В таблице 17 показан пример данных из серии с возрастающей дозой, а в таблице 18 приведены значения, полученные из такой серии.
Таблица 17 - Типичные данные, полученные из эксперимента с возрастающей дозой (число положительных тестов на стерильность из 20 испытаний, выполненных на отдельных единицах продукции)
Таблица 18 - Вычисления для стадии 2
11.2.2.3 Стадия 3: проведение эксперимента с возрастающей дозой
В таблице 19 приведены значения, полученные из эксперимента для стадии 3.
Таблица 19 - Вычисления для стадии 3
1.2.2.4* Стадии 4 и 5: рассмотрение результатов и установление стерилизующей дозы
В таблице 20 показаны вычисления, используемые для установления стерилизующей дозы.
Таблица 20 - Вычисления для установления стерилизующей дозы для стадии 4
11.2.3
Рабочий пример для метода 2А (
11.2.3.1
Стадия 1: выбор
11.2.3.1.1
Для конечного использования продукции
требуется
11.2.3.1.2 Распределение продукции для эксперимента с возрастающей дозой показано в таблице 21.
Таблица 21 - Число единиц продукции для облучения при различных возрастающих дозах
11.2.3.2 Стадия 2: проведение эксперимента с возрастающей дозой
В таблице 22 показан пример данных из серии эксперимента с возрастающей дозой, а в таблице 23 приведены значения, полученные из такой серии.
Таблица
22 - Типичные данные, полученные из
эксперимента с возрастающей дозой
(число положительных тестов на стерильность
из 20 испытаний, проведенных на
индивидуальных
Таблица 23 - Вычисления для стадии 2
11.2.3.3 Стадия 3: Проведение эксперимента с проверочной дозой
В таблице 24 приведены значения, полученные в эксперименте для стадии 3.
Таблица 24 - Вычисления для стадии 3
11.2.3.4 Стадии 4 и 5: рассмотрение результатов и установление стерилизующей дозы
В таблице 25 показаны вычисления для установления стерилизующей дозы.
Таблица 25 - Вычисления на стадии 4 для установления стерилизующей дозы
11.2.4 Рабочие примеры для метода 2В
11.2.4.1
Стадия 1: выбор
11.2.4.1.1
Для конечного использования продукции
требовался
11.2.4.1.2 Распределение продукции для эксперимента с возрастанием дозы показано в таблице 26.
Таблица 26 - Число единиц продукции для облучения при различных возрастающих дозах
11.2.4.2 Стадия 2: проведение эксперимента с возрастанием дозы
В таблице 27 дан пример из серии возрастающих доз, а в таблице 28 показаны вычисления.
Таблица 27 - Данные для возрастающих доз
Таблица 28 - Вычисления для стадии 2
11.2.4.3 Стадия 3: проведение эксперимента с возрастающей дозой
В таблице 29 показаны значения, полученные из эксперимента для стадии 3.
Таблица 29 - Вычисления для стадии 3
11.2.4.4 Стадии 4 и 5: рассмотрение результатов и установление стерилизующей дозы
В таблице 30 приведены вычисления для установления стерилизующей дозы.
Таблица 30 - Вычисления на стадии 4 для установления стерилизующей дозы
11.3
Рабочие примеры для метода
В
таблице 31 показан рабочий пример для
метода
Таблица
31 - Обоснование
Таблица
32 - Обоснование
11.4 Рабочий пример проверки стерилизующей дозы для установления дозы с использованием метода 1, заключением которого явилось требование увеличения стерилизующей дозы
Процедура
проверки стерилизующей дозы для метода
1 является одной и той же, независимо от
использования
Следующий
пример является продолжением примера
данного в таблице 13, где стерилизующая
доза была установлена для продукта с
конечным использованием, требующим
Таблица 33 является примером первой проверки стерилизующей дозы, проведенной после установления стерилизующей дозы.
Таблица 33 - Проверка стерилизующей дозы, после которой требуется увеличение дозы
11.5 Рабочий пример проверки стерилизующей дозы для установления дозы с использованием метода 2А, заключением которого явилось требование увеличения стерилизующей дозы
Процедуры
проверки стерилизующей дозы для метода
2А (
Пример,
приведенный в таблице 34, относится к
продукту, для которого стерилизующая
доза 21,8 кГр была первоначально установлена
с использованием метода 2А. Целый продукт
(
Таблица 34 - Проверка стерилизующей дозы, после которой требуется увеличение дозы
11.6
Рабочий пример проверки стерилизующей
дозы для обоснования стерилизующей
дозы с использованием метода
Процедура
проверки для метода
Таблица
35 - Проверка дозы
Библиография
Приложение ДА (справочное)
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам Таблица ДА.1
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||